题目内容
20.部分短周期元素的原子结构及相关性质如表所示:| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为
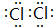 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.
分析 短周期元素中,T元素的最高正价与最低负价的代数和为4,则T为S元素;X元素原子最外层电子数是次电子数次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;常温下Y元素单质为双原子分子,其氢化物的水溶液呈碱性,则Y为N元素;Z元素的最高正价是+7价,则Z为Cl,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:(1)T为S元素,在元素周期表中的位置为:第三周期第ⅥA族,故答案为:第三周期第ⅥA族;
(2)X的一种同位素可用于测定文物年代,该同位素为,故答案为:614C;
(3)Z单质为Cl2,电子式为 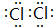 ;Y的氢化物为NH3,其水溶液显碱性的原因为:NH3+H2O?NH3•H2O?NH4++OH-,
;Y的氢化物为NH3,其水溶液显碱性的原因为:NH3+H2O?NH3•H2O?NH4++OH-,
故答案为: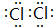 ;NH3+H2O?NH3•H2O?NH4++OH-;
;NH3+H2O?NH3•H2O?NH4++OH-;
(4)同周期自左而右非金属性减弱,Cl元素非金属性比硫的强,
a.物理性质不能说明非金属性强弱,故a错误;
b.氢化物酸性不能比较元素非金属性强弱,故b错误;
c.元素非金属性强弱与获得电子能力强弱有关,与最高正化合价无关,故c错误;
c.非金属性越强,最高价氧化物对应水化物的酸性越强,故d正确;
故答案为:Cl;d.
(5)Z的氢化物为HCl,Y的氢化物为NH3,二者发生化合反应生成NH4Cl,反应的化学方程式为HCl+NH3=NH4Cl,NH4Cl中含有离子键、共价键,
故答案为:HCl+NH3=NH4Cl;离子键、共价键.
点评 本题考查结构性质位置关系综合应用,为高考常见题型,侧重于学生的分析能力的考查,难度不大,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.100mL 6mol/L的硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( ) ①硫酸钠固体,②醋酸钠固体,③硫酸钾溶液,④硝酸钾溶液.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
5.高炉炼铁过程中发生的主要反应为$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如表:
请回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<(填>、<或=);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积 F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正)>V(逆) (填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•L-1•min-1CO的平衡转化率=60%.
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$,△H<(填>、<或=);
(2)欲提高反应中CO的平衡转化率,可采取的措施是C;
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.加入合适的催化剂 E.增大容器的容积 F.提高反应温度
(3)在一个容积为1L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各2.0mol,此时V(正)>V(逆) (填“>”“<”或“=”),若反应经过5min后达到平衡.求该时间范围内反应的平均反应速率:v (CO2)=0.24mol•L-1•min-1CO的平衡转化率=60%.
9.下表列出了3种燃煤烟气脱硫方法的原理.
(1)方法1中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3;(NH4)2SO3+SO2+H2O=2NH4HSO3.下列能提高燃煤烟气中SO2去除速率的措施有A(填字母).
A.适当增大氨水浓度 B.使燃煤烟气与氨水充分接触
C.向氨水中加入少量硫酸 D.把氨水加热至100℃
(2)方法2中主要发生了下列反应:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0KJ•mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4KJ•mol-1
该方法从能量转化的角度,可看作由热能转化为化学能.
(3)方法3可用甲烷燃料电池作为电源,对吸收SO2后的NaHSO3溶液进行电解实验,如图所示.回答下列问题:
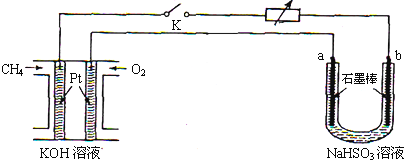
①甲烷燃料电池中,通入CH4(填“CH4”或“O2”)的一极为负极;正极的电极反应式为O2+4e-+2H2O=4OH-;该电池放电后,溶液的碱性会减弱(填“增强”,“减弱”或“不变”).
下列关于该燃料电池的说法中不正确的是B.
A.该燃料电池可把化学能直接转变为电能
B.该燃料电池中化学能100%转变为电能
C.该燃料电池的优点之一是无污染,是一种具有应用前景的绿色电源
②a电极的名称是阳极;闭合开关K后,b电极上发生的反应类型是还原反应.
③若上述甲烷燃料电池中用的是200mL 0.10mol•L-1的KOH溶液,闭合开关K一段时间后,测得U形管中生成了0.02molSO42-.试计算此时燃料电池中KOH的物质的量浓度(假设反应前后溶液的体积不变,列出计算过程).
| 方法1 | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法2 | 用水煤气(主要成分为CO、H2等)将SO2在高温下还原成单质硫 |
| 方法3 | 用Na2SO3溶液吸收SO2转化为NaHSO3,再经电解转化为H2SO4 |
A.适当增大氨水浓度 B.使燃煤烟气与氨水充分接触
C.向氨水中加入少量硫酸 D.把氨水加热至100℃
(2)方法2中主要发生了下列反应:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0KJ•mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4KJ•mol-1
该方法从能量转化的角度,可看作由热能转化为化学能.
(3)方法3可用甲烷燃料电池作为电源,对吸收SO2后的NaHSO3溶液进行电解实验,如图所示.回答下列问题:
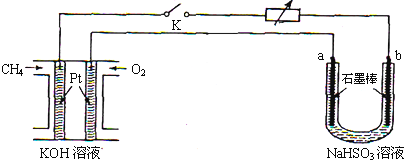
①甲烷燃料电池中,通入CH4(填“CH4”或“O2”)的一极为负极;正极的电极反应式为O2+4e-+2H2O=4OH-;该电池放电后,溶液的碱性会减弱(填“增强”,“减弱”或“不变”).
下列关于该燃料电池的说法中不正确的是B.
A.该燃料电池可把化学能直接转变为电能
B.该燃料电池中化学能100%转变为电能
C.该燃料电池的优点之一是无污染,是一种具有应用前景的绿色电源
②a电极的名称是阳极;闭合开关K后,b电极上发生的反应类型是还原反应.
③若上述甲烷燃料电池中用的是200mL 0.10mol•L-1的KOH溶液,闭合开关K一段时间后,测得U形管中生成了0.02molSO42-.试计算此时燃料电池中KOH的物质的量浓度(假设反应前后溶液的体积不变,列出计算过程).
10.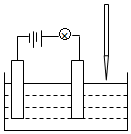 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 醋酸中逐滴加入氢氧化钠溶液 | B. | 硫酸钠中逐滴加入氢氧化钡溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 盐酸中逐滴加入硝酸银溶液 |
 H2SO32H2SO3+O2
H2SO32H2SO3+O2 2H2SO4.
2H2SO4. 2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小.
2SO3反应的△H=-198kJ/mol,是放热反应.当压强一定时,温度升高,平衡左移,SO2平衡转化率减小. FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题: