题目内容
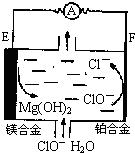 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
考点:原电池和电解池的工作原理
专题:
分析:“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极,失去电子生成Mg(OH)2,正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-,以此解答该题.
解答:
解:A.镁合金被氧化生成Mg(OH)2,应为原电池负极,故A错误;
B.负极发生氧化反应,而ClO-+2e-+H2O=Cl-+2OH-应为原电池正极反应,故B错误;
C.正极发生ClO-+2e-+H2O=Cl-+2OH-,正极周围溶液的pH将不断变大,故C错误;
D.Mg的活泼性较强能与水反应生成氢气,其反应为:Mg+2H2O═Mg(OH)2+H2↑,发生自腐蚀产生氢气,使负极利用率降低,故D正确.
故选D.
B.负极发生氧化反应,而ClO-+2e-+H2O=Cl-+2OH-应为原电池正极反应,故B错误;
C.正极发生ClO-+2e-+H2O=Cl-+2OH-,正极周围溶液的pH将不断变大,故C错误;
D.Mg的活泼性较强能与水反应生成氢气,其反应为:Mg+2H2O═Mg(OH)2+H2↑,发生自腐蚀产生氢气,使负极利用率降低,故D正确.
故选D.
点评:本题考查了原电池原理的分析应用,为高频考点,侧重于学生的分析能力的考查,注意把握原电池原理的工作原理以及电极方程式的书写,题目难度中等.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
已知:Ksp(AgCl)=1.56×10-10,Ksp(AgI)=1.56×10-16,Ksp(Ag2CrO4)=2.0×10-12.下列有关说法正确的是( )
| A、相同温度下,饱和溶液中的Ag+浓度:AgCl>Ag2CrO4>AgI |
| B、向饱和食盐水中加AgNO3,形成AgCl沉淀时,溶液中的Ag+浓度为1.34×10-5 mol?L-1 |
| C、向含AgI难溶物的溶液中,逐滴加入饱和食盐水,原难溶物会变成白色 |
| D、向含Cl-、I-和CrO42-浓度均为0.010 mol?L-1的溶液中,逐滴加入AgNO3溶液,最先形成Ag2CrO4沉淀 |
下列物质中,能使酸性高锰酸钾溶液褪色的是( )
| A、苯 | B、乙烷 | C、乙烯 | D、乙酸 |
下列依据热化学方程式得出的结论正确的是( )
| A、已知:C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| B、已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1,则氢气的燃烧热为241.8kJ?mol-1 |
| C、已知:500℃、30MPa下,N2(g)+3H2(g)?2NH3 (g)△H=-38.6kJ?mol-1;将1.5molH2和过量的N2在此条件下充分反应,放出热量19.3kJ |
| D、已知:H2(g)+F2(g)═HF(g)△H=-270kJ?mol-1,则相同条件下,2molHF气体的能量小于1mol氢气和1mol氟气的能量之和 |
以0.10mol/L的氢氧化钠溶液滴定某一元弱酸(已知其在该条件下的电离度α≈1%)的滴定曲线如图所示.横坐标为加入氢氧化钠的体积,纵坐标为溶液的pH.下列说法正确的是( )


| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验可选用甲基橙作指示剂 |
| D、此实验可选用酚酞作指示剂 |
有关元素性质递变规律的叙述正确的是( )
| A、同主族元素从上到下,单质的熔点逐渐降低 |
| B、同主族元素从上到下,氢化物的熔点逐渐降低 |
| C、同周期元素(除零族元素外)从左到右,简单离子半径逐渐减小 |
| D、同周期元素(除零族元素外)从左到右,原子失电子能力逐渐减弱 |
 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( ) 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用