题目内容
以0.10mol/L的氢氧化钠溶液滴定某一元弱酸(已知其在该条件下的电离度α≈1%)的滴定曲线如图所示.横坐标为加入氢氧化钠的体积,纵坐标为溶液的pH.下列说法正确的是( )


| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验可选用甲基橙作指示剂 |
| D、此实验可选用酚酞作指示剂 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A.依据平衡常数概念计算该一元弱酸的电离常数(Ka);
B.由图象可知,当V=0mL,1×10-4mol?L-1,结合电离度为1%计算出其浓度;
C.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
D.恰好中和时生成强碱弱酸盐,应选择碱性条件下变色的指示剂.
B.由图象可知,当V=0mL,1×10-4mol?L-1,结合电离度为1%计算出其浓度;
C.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
D.恰好中和时生成强碱弱酸盐,应选择碱性条件下变色的指示剂.
解答:
解:A.由图象分析可知,c(H+)=1×10-4mol?L-1,但HA是弱酸,不完全电离,所以HA的浓度为大于1×10-4mol?L-1,由图象可知,当V=10mL,酸碱恰好中和,一元弱酸电离程度近似为1%,所以弱酸起始浓度为10-2mol/L,平衡常数≈
=10-6,故A正确;
B.由图象可知,当V=0mL,溶液中离子浓度为:1×10-4mol?L-1,一元弱酸电离程度近似为1%,所以弱酸起始浓度为:
mol/L=10-2mol/L,故B错误;
C.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,不能选择甲基橙,应选择酚酞指示剂,故C错误;
D.根据C的分析可知,恰好中和时生成显示碱性的强碱弱酸盐,应该选用酚酞作指示剂,故D正确;
故选AD.
| 10-4×10-4 |
| 10-2 |
B.由图象可知,当V=0mL,溶液中离子浓度为:1×10-4mol?L-1,一元弱酸电离程度近似为1%,所以弱酸起始浓度为:
| 10-4 |
| 1% |
C.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,不能选择甲基橙,应选择酚酞指示剂,故C错误;
D.根据C的分析可知,恰好中和时生成显示碱性的强碱弱酸盐,应该选用酚酞作指示剂,故D正确;
故选AD.
点评:本题考查酸碱混合的定性判断及pH的计算,题目难度中等,本题注意把握弱电解质的电离特点,明确酸碱混合的定性判断方法及溶液酸碱性与溶液pH的计算,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
下列说法正确的是( )
| A、除去NO中混有的NO2将混合气体先通过足量水,然后用CaCl2干燥 |
| B、配制一定物质的量浓度的Fe(NO3)2溶液:将一定量的Fe(NO3)2溶于适量的硝酸中,再加入水稀释至指定浓度 |
| C、向足量饱和石灰水中加入少CaO,恢复至室温后溶液pH变大 |
| D、工业上分別用电解熔融Al2O3、MgO、NaCl的方法制取Al、Mg、Na |
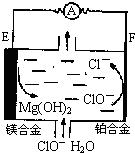 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )


| A、电池工作时,正极反应式为O2+2H2O+4e-=4OH- |
| B、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C、试管中NaOH溶液是用来吸收电解时产生的Cl2 |
| D、当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.021mol气体 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、200mL1molAl2(SO4)3溶液中,Al3+和SO42-离子数的总和为NA |
| B、标准状况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA |
| D、0.1molO2和O3的混合气体中含氧原子数目为0.2NA |
对可逆反应2SO2(g)+O2 (g)?2SO3 (g),下列判断正确的是( )
| A、若单位时间内生成xmolSO3 的同时,消耗xmolSO2,则反应达到平衡状态 |
| B、达到化学平衡状态,2v正(O2)=v逆(SO3 ) |
| C、平衡时,SO2的浓度必定等于O2 浓度的2倍 |
| D、达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 |

 K,Fe,C,N,O,S是中学化学常见的六种元素.
K,Fe,C,N,O,S是中学化学常见的六种元素.