题目内容
3.01×1023个OH-的物质的量为 mol,含有电子的物质的量为 mol.
考点:物质的量的相关计算
专题:计算题
分析:根据n=
计算氢氧根离子物质的量,再根据1molOH-含有10mol电子计算.
| N |
| NA |
解答:
解:3.01×1023个OH-的物质的量n(OH-)=
=
=0.5mol,n(e-)=0.5mol×10=5mol,
故答案为:0.5mol;5mol.
| N |
| NA |
| 3.01×1023 |
| 6.02×1023mol-1 |
故答案为:0.5mol;5mol.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用,难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
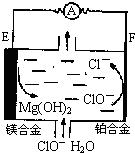 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、200mL1molAl2(SO4)3溶液中,Al3+和SO42-离子数的总和为NA |
| B、标准状况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA |
| D、0.1molO2和O3的混合气体中含氧原子数目为0.2NA |
下列各组物质中,化学键类型相同,晶体类型也相同的是( )
| A、CH4和 H2O |
| B、KCl 和 HCl |
| C、Cl2 和 KCl |
| D、SiO2 和 CO2 |
X、Y、Z是原子序数依次增大且属于不同周期的三种常见短周期元素,三种元素相互之间可以形成1:1型的化合物R、M、N,常温下M、N为固体,R为液体.M、N遇到水都能产生气体,而且产生的气体相互可以化合,下列说法正确的是( )
| A、三种元素都是非金属元素 |
| B、由三种元素形成的物质既含离子键又含共价键 |
| C、三种化合物都是共价化合物 |
| D、各1mol的M、N与水反应所得气体体积比为1:1 |
对可逆反应2SO2(g)+O2 (g)?2SO3 (g),下列判断正确的是( )
| A、若单位时间内生成xmolSO3 的同时,消耗xmolSO2,则反应达到平衡状态 |
| B、达到化学平衡状态,2v正(O2)=v逆(SO3 ) |
| C、平衡时,SO2的浓度必定等于O2 浓度的2倍 |
| D、达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 |
下列方法中,正确的是( )
| A、用湿润的红色石蕊试纸检验氨气 |
| B、在样品溶液中先加入硝酸银溶液,再加入稀硝酸,若白色沉淀存在,则样品中含有Cl- |
| C、将熟石灰和氯化铵混合加热,可以制备氨气 |
| D、加热试管中的氯化铵固体 |
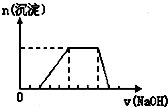 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是