题目内容
 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜,该工艺的中间过程会发生反应:2Cu2O+Cu2S=6Cu+SO2,该反应的氧化剂是
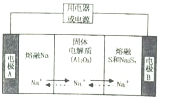
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2S4)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:
①根据表中数据,请你判断该电池工作的适宜温度应控制在
| 物质 | Na | s | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
②放电时,电极A为
③放电时,内电路中Na+的移动方向为
④充电时,总反应为Na2S2=2Na+S2(3<x<5)Na所在电极与直流电源
考点:常见金属元素的单质及其化合物的综合应用,原电池和电解池的工作原理,铜金属及其重要化合物的主要性质
专题:
分析:(1)2Cu2O+Cu2S=6Cu+SO2中,Cu元素的化合价降低,S它本身的化合价升高,结合元素的化合价计算转移电子;吸氧腐蚀中负极上Cu失去电子;
(2)原电池工作时,控制的温度应为满足Na、S为熔融状态,Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此来解答.
(2)原电池工作时,控制的温度应为满足Na、S为熔融状态,Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此来解答.
解答:
解:(1)2Cu2O+Cu2S=6Cu+SO2中,Cu元素化合价由+1价降低到0价,硫元素化合价由-2价升高为+4价,所以氧化剂为Cu2O、Cu2S;由方程式可知,生成6molCu,转移电子6mol,由方程式可知,生成Cu为
=0.3mol,转移电子0.3mol×(1-0)=0.3mol,即转移电子的物质的量为0.3mol;吸氧腐蚀中负极上Cu失去电子,负极反应式为Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O,
故答案为:Cu2O、Cu2S;0.3;Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O;
(2)①原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有c符合,故答案为:c;
②放电时,Na被氧化,A应为原电池负极,S在正极上得到电子发生还原反应,故答案为:负;还原;
③阳离子向正极移动,即从A到B,故答案为:从A到B;
④充电时,是电解池反应,Na所在电极与直流电源负极相连,而阳极反应为:Sx2--2e-=xS,故答案为:负;Sx2--2e-=xS.
| 19.2g |
| 64g/mol |
故答案为:Cu2O、Cu2S;0.3;Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O;
(2)①原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有c符合,故答案为:c;
②放电时,Na被氧化,A应为原电池负极,S在正极上得到电子发生还原反应,故答案为:负;还原;
③阳离子向正极移动,即从A到B,故答案为:从A到B;
④充电时,是电解池反应,Na所在电极与直流电源负极相连,而阳极反应为:Sx2--2e-=xS,故答案为:负;Sx2--2e-=xS.
点评:本题考查氧化还原反应及原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握反应中元素的化合价变化及原电池的工作原理以及电极方程式的书写,答题时注意体会,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
有4种碳骨架如下的烃,下列说法正确的是( )

①a和d是同分异构体
②b和c是同系物
③a和d都能发生加聚反应
④只有b和c能发生取代反应.

①a和d是同分异构体
②b和c是同系物
③a和d都能发生加聚反应
④只有b和c能发生取代反应.
| A、①② | B、①④ | C、②③ | D、①②③ |
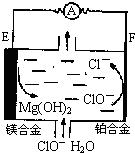 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
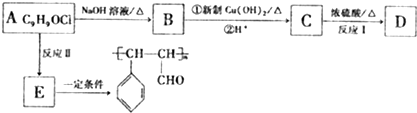
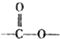 结构的芳香族化介物的同分异构体有
结构的芳香族化介物的同分异构体有
 K,Fe,C,N,O,S是中学化学常见的六种元素.
K,Fe,C,N,O,S是中学化学常见的六种元素.