题目内容
有关元素性质递变规律的叙述正确的是( )
| A、同主族元素从上到下,单质的熔点逐渐降低 |
| B、同主族元素从上到下,氢化物的熔点逐渐降低 |
| C、同周期元素(除零族元素外)从左到右,简单离子半径逐渐减小 |
| D、同周期元素(除零族元素外)从左到右,原子失电子能力逐渐减弱 |
考点:同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系
专题:
分析:A.碱金属元素,单质的熔沸点随着原子序数增大而减小,卤族元素,单质的熔沸点随着原子序数增大而升高;
B.同一主族元素,氢化物的熔沸点随着相对分子质量增大而升高,但含有氢键的物质熔沸点较高;
C.同一周期元素,从左到右,简单离子半径先减小后增大再减小;
D.元素的金属性越强,其原子失电子能力越强.
B.同一主族元素,氢化物的熔沸点随着相对分子质量增大而升高,但含有氢键的物质熔沸点较高;
C.同一周期元素,从左到右,简单离子半径先减小后增大再减小;
D.元素的金属性越强,其原子失电子能力越强.
解答:
解:A.碱金属元素,单质的熔沸点随着原子序数增大而减小,卤族元素,单质的熔沸点随着原子序数增大而升高,所以同主族元素从上到下,单质的熔点可能逐渐降低、可能逐渐升高,故A错误;
B.同一主族元素,氢化物的熔沸点随着相对分子质量增大而升高,但含有氢键的物质熔沸点较高,碳族元素氢化物的熔点随着原子序数增大而增大,故B错误;
C.同一周期元素,从左到右,简单离子半径先减小后增大再减小,第IIIA族元素简单离子半径最小,而不是简单的减小,故C错误;
D.元素的金属性越强,其原子失电子能力越强,同一周期元素,元素的金属性随着原子序数增大而减弱,非金属性随着原子序数增大而增强,所以同周期元素(除零族元素外)从左到右,原子失电子能力逐渐减弱,得电子的能力越强,故D正确;
故选D.
B.同一主族元素,氢化物的熔沸点随着相对分子质量增大而升高,但含有氢键的物质熔沸点较高,碳族元素氢化物的熔点随着原子序数增大而增大,故B错误;
C.同一周期元素,从左到右,简单离子半径先减小后增大再减小,第IIIA族元素简单离子半径最小,而不是简单的减小,故C错误;
D.元素的金属性越强,其原子失电子能力越强,同一周期元素,元素的金属性随着原子序数增大而减弱,非金属性随着原子序数增大而增强,所以同周期元素(除零族元素外)从左到右,原子失电子能力逐渐减弱,得电子的能力越强,故D正确;
故选D.
点评:本题考查同一周期、同一主族元素性质递变规律,侧重考查元素周期律的认识,注意规律中的特殊现象,知道氢键对氢化物熔沸点的影响,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
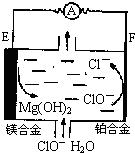 镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔.如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金.关于该电池的叙述正确的是( )| A、E为该燃料电池的正极 |
| B、负极发生的电极反应式为ClO-+2e-+H2O=Cl-+2OH- |
| C、电池工作时,正极周围溶液的pH将不断变小 |
| D、镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )


| A、电池工作时,正极反应式为O2+2H2O+4e-=4OH- |
| B、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C、试管中NaOH溶液是用来吸收电解时产生的Cl2 |
| D、当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.021mol气体 |
下列化学用语的表述正确的是( )
A、离子结构示意图: 可以表示16O2-,也可以表示18O2- 可以表示16O2-,也可以表示18O2- |
B、比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 |
C、氯化铵的电子式为: |
| D、CO2的结构式为:O-C-O |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、200mL1molAl2(SO4)3溶液中,Al3+和SO42-离子数的总和为NA |
| B、标准状况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA |
| D、0.1molO2和O3的混合气体中含氧原子数目为0.2NA |
下列各组物质中,化学键类型相同,晶体类型也相同的是( )
| A、CH4和 H2O |
| B、KCl 和 HCl |
| C、Cl2 和 KCl |
| D、SiO2 和 CO2 |
下列方法中,正确的是( )
| A、用湿润的红色石蕊试纸检验氨气 |
| B、在样品溶液中先加入硝酸银溶液,再加入稀硝酸,若白色沉淀存在,则样品中含有Cl- |
| C、将熟石灰和氯化铵混合加热,可以制备氨气 |
| D、加热试管中的氯化铵固体 |
 6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题: K,Fe,C,N,O,S是中学化学常见的六种元素.
K,Fe,C,N,O,S是中学化学常见的六种元素.