题目内容
为了除去KCl溶液中少量的CaCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作:
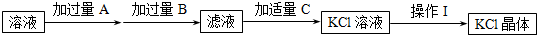
(1)A、B、C依次为 .
(2)加过量A的有关反应的离子方程式为: .
(3)加入过量B的目的是: .有关反应的离子方程式为 .
(4)操作 I的步骤依次为 .
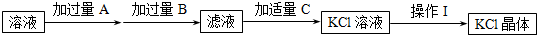
(1)A、B、C依次为
(2)加过量A的有关反应的离子方程式为:
(3)加入过量B的目的是:
(4)操作 I的步骤依次为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:除去KCl溶液中的少量CaCl2和MgSO4,可看成把Ca2+、Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2以及原有的CaCl2可加入所选试剂中的K2CO3而除去;最后通过滴加盐酸可把过量的K2CO3及反应生成的KOH同时反应掉而生成KCl,将KCl溶液进行蒸发操作可得到KCl,以此解答该题.
解答:
解:除去KCl溶液中的少量CaCl2和MgSO4,可看成把Ca2+、Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2以及原有的CaCl2可加入所选试剂中的K2CO3而除去;最后通过滴加盐酸可把过量的K2CO3及反应生成的KOH同时反应掉而生成KCl,将KCl溶液进行蒸发操作可得到KCl,
(1)由以上分析可知A为Ba(OH)2、B为K2CO3、C为HCl,故答案为:Ba(OH)2、K2CO3、HCl;
(2)加入Ba(OH)2,可生成氢氧化镁和硫酸钡沉淀,反应的离子方程式为Mg2++SO42-+Ba2++2OH-═Mg(OH)2↓+BaSO4↓,
故答案为:Mg2++SO42-+Ba2++2OH-═Mg(OH)2↓+BaSO4↓;
(3)加入过量的K2CO3溶液可使滤液中混有的Ba(OH)2以及原有的CaCl2完全反应而除去;相关反应的化学方程式有Ba(OH)2+K2CO3═BaCO3↓+2KOH、CaCl2+K2CO3═CaCO3↓+2KCl,反应的离子方程式为CO32-+Ba2+═BaCO3↓、CO32-+Ca2+═CaCO3↓,
故答案为:为了除尽Ca2+和过量的Ba2+;CO32-+Ba2+═BaCO3↓、CO32-+Ca2+═CaCO3↓;
(4)操作Ⅰ是由氯化钾溶液得到氯化钾晶体,可进行操作加热蒸发、冷却结晶,
故答案为:加热蒸发、冷却结晶.
(1)由以上分析可知A为Ba(OH)2、B为K2CO3、C为HCl,故答案为:Ba(OH)2、K2CO3、HCl;
(2)加入Ba(OH)2,可生成氢氧化镁和硫酸钡沉淀,反应的离子方程式为Mg2++SO42-+Ba2++2OH-═Mg(OH)2↓+BaSO4↓,
故答案为:Mg2++SO42-+Ba2++2OH-═Mg(OH)2↓+BaSO4↓;
(3)加入过量的K2CO3溶液可使滤液中混有的Ba(OH)2以及原有的CaCl2完全反应而除去;相关反应的化学方程式有Ba(OH)2+K2CO3═BaCO3↓+2KOH、CaCl2+K2CO3═CaCO3↓+2KCl,反应的离子方程式为CO32-+Ba2+═BaCO3↓、CO32-+Ca2+═CaCO3↓,
故答案为:为了除尽Ca2+和过量的Ba2+;CO32-+Ba2+═BaCO3↓、CO32-+Ca2+═CaCO3↓;
(4)操作Ⅰ是由氯化钾溶液得到氯化钾晶体,可进行操作加热蒸发、冷却结晶,
故答案为:加热蒸发、冷却结晶.
点评:本题考查物质的分离、提纯知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,为解答该题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设 NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、16g CH4中含有10NA个电子 |
| B、1mol?L-1NaCl溶液含有NA个Na+ |
| C、1mol Cu和足量稀硝酸反应产生NA个NO分子 |
| D、常温常压下,22.4L CO2中含有NA个CO2分子 |
 如右图所示
如右图所示