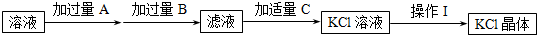题目内容
用质量分数为36.5%的浓盐酸(密度为1.16g?cm-3)配制成1mol?L-1的稀盐酸.现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为 mL的容量瓶.
(2)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 .
A.5mL B.10mL C.25mL D.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中.
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号) .
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”).若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”).
(1)配制稀盐酸时,应选用容量为
(2)经计算需要
A.5mL B.10mL C.25mL D.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中.
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据配制溶液的体积,常用容量瓶的规格选取对应的容量瓶;
(2)依据C=
计算浓盐酸的物质的量浓度,然后根据溶液稀释前后物质的量不变计算所需浓盐酸的体积,选择合适的量筒;
(3)根据配置一定物质的量浓度溶液的实验操作步骤解答;
(4)根据c=
分析操作对溶质的物质的量或对溶液的体积的影响,凡是能够使n偏大或者使V偏小的操作,都会使C偏大,凡是能够使n偏小或者使V偏大的操作都会使浓度C偏小据此判断.
(2)依据C=
| 1000ρω |
| M |
(3)根据配置一定物质的量浓度溶液的实验操作步骤解答;
(4)根据c=
| n |
| V |
解答:
解:(1)要配制盐酸220mL,则需要选择250ml的容量瓶,故答案为:250;
(2)浓盐酸的物质的量浓度C=
=
=11.6mol/L,设所需浓盐酸的体积为V,则有V×11.6mol/L=O.25L×1mol/L,得V=O.0216L,即21.6ml,应选择25ml的量筒,
故答案为:21.6;C;
(3)配制一定物质的量浓度的溶液的一般操作步骤有计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶,故上述操作中,正确的顺序是③①④②,
故答案为:③①④②;
(4)根据c=
分析操作对溶质的物质的量或对溶液的体积的影响,凡是能够使n偏大或者使V偏小的操作,都会使C偏大,凡是能够使n偏小或者使V偏大的操作都会使浓度C偏小.
在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,相当于稀释浓盐酸,所取盐酸的物质的量n偏小,配得溶液的浓度偏低;
未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,溶质氯化氢没能全部转移到容量瓶,n偏小,配得的溶液的浓度偏低;
故答案为:偏低;偏低.
(2)浓盐酸的物质的量浓度C=
| 1000ρω |
| M |
| 1000×1.16g/ml×36.5% |
| 36.5g/mol |
故答案为:21.6;C;
(3)配制一定物质的量浓度的溶液的一般操作步骤有计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶,故上述操作中,正确的顺序是③①④②,
故答案为:③①④②;
(4)根据c=
| n |
| V |
在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,相当于稀释浓盐酸,所取盐酸的物质的量n偏小,配得溶液的浓度偏低;
未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,溶质氯化氢没能全部转移到容量瓶,n偏小,配得的溶液的浓度偏低;
故答案为:偏低;偏低.
点评:本题考查了配置一定物质的量浓度溶液,明确实验的操作步骤是解题关键,注意误差的分析应依据c=
进行.
| n |
| V |

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
下列实验方案合理的是( )
| A、鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 |
| B、检验酒精中的少量水:向酒精中加入足量生石灰 |
| C、制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D、除去乙炔中杂质气体:将实验室制得的乙炔气体通入硫酸铜溶液 |
设NA为阿伏加德罗常数,下面叙述正确的是( )
| A、标准状况下,11.2L SO3所含分子数为0.5 NA |
| B、1L 1mol/L的氯化钠溶液中,所含离子数为NA |
| C、64g二氧化硫含有原子数为3NA |
| D、在反应中,1mol镁转化为Mg2+后失去的电子数为NA |
 的烃跟D2以等物质的量混合,并在一定条件下反应,所得产物的结构简式可能是(其中加重氢原子的碳原子均为*号标记)( )
的烃跟D2以等物质的量混合,并在一定条件下反应,所得产物的结构简式可能是(其中加重氢原子的碳原子均为*号标记)( )



 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:

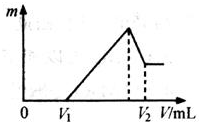 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: