题目内容
硼化合物种类丰富,用途广泛.结合下列信息回答问题:
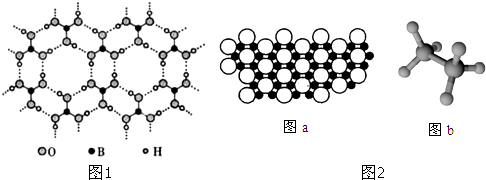
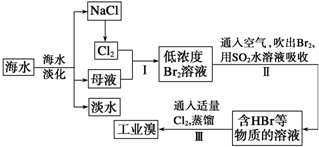
Ⅰ、硼酸能够吸收中子,屏蔽核辐射.其水溶液呈弱酸性,机理是:硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,导致溶液中C(H+)>c( OH-).硼酸晶体具有层状结构,每一层结构如图1所示.
(1)硼酸晶体属于 (填“离子晶体”、“分子晶体”或“原子晶体”).
(2)硼酸晶体中,微粒间的存在的作用力有 .
A.金属件 B.共价键 C.离子键 D..配位键 E.氢键 F.范德华力
(3)三氟化硼(BF3)水解生成硼酸和氟硼酸(H[BF4]),该反应的化学方程式为: .
(4)下列关于硼酸的说法正确的是 .
A.H3BO3是一元酸
B.其水溶液中,水的电离平衡受到抑制
C.晶体中有氢键,因此硼酸分子较稳定
D.分子中B与O原子均达到8电子稳定结构
E.1mol H3BO3晶体中含有3mol氢键
Ⅱ、科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列.图a是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图2中的硼原子和镁原子投影在同一平面上.
(5)根据图示确定硼化镁的化学式为 .
Ⅲ、氨硼烷(NBH6)是一种有效、安全的固体储氢材料.氨硼烷的结构如图b和乙烷相似.
(6)氨硼烷分子与硼酸分子中硼原子的杂化轨道类型分别为 和 .

Ⅰ、硼酸能够吸收中子,屏蔽核辐射.其水溶液呈弱酸性,机理是:硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,导致溶液中C(H+)>c( OH-).硼酸晶体具有层状结构,每一层结构如图1所示.
(1)硼酸晶体属于
(2)硼酸晶体中,微粒间的存在的作用力有
A.金属件 B.共价键 C.离子键 D..配位键 E.氢键 F.范德华力
(3)三氟化硼(BF3)水解生成硼酸和氟硼酸(H[BF4]),该反应的化学方程式为:
(4)下列关于硼酸的说法正确的是
A.H3BO3是一元酸
B.其水溶液中,水的电离平衡受到抑制
C.晶体中有氢键,因此硼酸分子较稳定
D.分子中B与O原子均达到8电子稳定结构
E.1mol H3BO3晶体中含有3mol氢键
Ⅱ、科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列.图a是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图2中的硼原子和镁原子投影在同一平面上.
(5)根据图示确定硼化镁的化学式为
Ⅲ、氨硼烷(NBH6)是一种有效、安全的固体储氢材料.氨硼烷的结构如图b和乙烷相似.
(6)氨硼烷分子与硼酸分子中硼原子的杂化轨道类型分别为
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:Ⅰ、(1)硼酸为白色结晶性粉末,属于分子晶体,分子式为:H3BO3;
(2)化学键是指分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用;
(3)根据题干信息:反应物为三氟化硼和水,生成物为硼酸和氟硼酸(H[BF4]),据此书写方程式;
(4)A.硼酸中B原子属于缺电子原子,1个H3BO3可以结合1个水分子电离出的氢氧根,生成一个氢离子;
B.硼酸中B原子属于缺电子原子,H3BO3可以结合水电离出的氢氧根显酸性;
C.分子的稳定性与化学键有关;
D.由结构可知,硼原子最外层只有3个电子,与氧原子形成3对共用电子对;
E.由结构可知,一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子;
Ⅱ、(5)1个B原子为3个Mg原子共用,1个Mg原子为6个B原子共用,可以计算硼原子和镁元自得个数之比
Ⅲ、(6)氨硼烷的结构和乙烷相似,NH3-BH3,硼原子最外层只有3个电子,与H、N形成四对共用电子对,硼酸[B(OH)3]分子中,氧原子形成3对共用电子对,价层电子对为3,杂化轨道数为3;根据分子的空间结构以及成键元素确定杂化类型.
(2)化学键是指分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用;
(3)根据题干信息:反应物为三氟化硼和水,生成物为硼酸和氟硼酸(H[BF4]),据此书写方程式;
(4)A.硼酸中B原子属于缺电子原子,1个H3BO3可以结合1个水分子电离出的氢氧根,生成一个氢离子;
B.硼酸中B原子属于缺电子原子,H3BO3可以结合水电离出的氢氧根显酸性;
C.分子的稳定性与化学键有关;
D.由结构可知,硼原子最外层只有3个电子,与氧原子形成3对共用电子对;
E.由结构可知,一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子;
Ⅱ、(5)1个B原子为3个Mg原子共用,1个Mg原子为6个B原子共用,可以计算硼原子和镁元自得个数之比
Ⅲ、(6)氨硼烷的结构和乙烷相似,NH3-BH3,硼原子最外层只有3个电子,与H、N形成四对共用电子对,硼酸[B(OH)3]分子中,氧原子形成3对共用电子对,价层电子对为3,杂化轨道数为3;根据分子的空间结构以及成键元素确定杂化类型.
解答:
解:Ⅰ、(l)硼酸晶体中存在H3BO3分子,因此,是分子晶体,故答案为:分子晶体;
(2)在硼酸[B(OH)3]分子中,硼原子与氧原子形成共价健、羟基中氢原子和氧原子间形成共价键,硼酸分子与硼酸分子间形成氢键、范德华力,
故答案为:B、E、F;
(3)三氟化硼(BF3)水解生成硼酸和氟硼酸(H[BF4]),反应方程式为4BF3+3H2O?3H[BF4]+H3BO3,
故答案为:4BF3+3H2O?3H[BF4]+H3BO3;
(4)A.硼酸中B原子属于缺电子原子,在水溶液中可以结合水电离出的氢氧根,B(OH)3+H2O=B(OH)4-+H+显酸性,所以为一元酸,故A正确;
B.硼酸中B原子属于缺电子原子,所以水溶液中可以结合水电离出的氢氧根,破坏水的电离平衡而使溶液显酸性,促进水的电离,故B错误;
C.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,故C错误;
D.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,故D错误;
E.一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,故E正确;
故答案为:A、E;
Ⅱ、(5)根据投影可知,1个B原子为3个Mg原子共用,故属于一个Mg原子的B原子为
;1个Mg原子为6个B原子共用,故用于一个B原子的Mg原子为
,由此可知Mg:N(Mg):N(B)N=
:
=1:2,故硼化镁的化学式为MgB2,
故答案为:MgB2;
Ⅲ、(6)氨硼烷分子中氮原子、硼原子有三个单电子,它们的杂化轨道类型分别为sp3、sp3,在硼酸[B(OH)3]分子中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,价层电子对为3,杂化轨道数为3,杂化类型为sp2,
故答案为:sp3;sp2.
(2)在硼酸[B(OH)3]分子中,硼原子与氧原子形成共价健、羟基中氢原子和氧原子间形成共价键,硼酸分子与硼酸分子间形成氢键、范德华力,
故答案为:B、E、F;
(3)三氟化硼(BF3)水解生成硼酸和氟硼酸(H[BF4]),反应方程式为4BF3+3H2O?3H[BF4]+H3BO3,
故答案为:4BF3+3H2O?3H[BF4]+H3BO3;
(4)A.硼酸中B原子属于缺电子原子,在水溶液中可以结合水电离出的氢氧根,B(OH)3+H2O=B(OH)4-+H+显酸性,所以为一元酸,故A正确;
B.硼酸中B原子属于缺电子原子,所以水溶液中可以结合水电离出的氢氧根,破坏水的电离平衡而使溶液显酸性,促进水的电离,故B错误;
C.分子的稳定性与分子内的B-O、H-O共价键有关,熔沸点与氢键有关,故C错误;
D.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,故D错误;
E.一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,故E正确;
故答案为:A、E;
Ⅱ、(5)根据投影可知,1个B原子为3个Mg原子共用,故属于一个Mg原子的B原子为
| 1 |
| 3 |
| 1 |
| 6 |
| 1 |
| 6 |
| 1 |
| 3 |
故答案为:MgB2;
Ⅲ、(6)氨硼烷分子中氮原子、硼原子有三个单电子,它们的杂化轨道类型分别为sp3、sp3,在硼酸[B(OH)3]分子中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,价层电子对为3,杂化轨道数为3,杂化类型为sp2,
故答案为:sp3;sp2.
点评:本题考查了晶体类型的判断、影响分子稳定性的因素、原子的杂化方式等知识点,题目难度较大,综合性强,注意分子的稳定性与化学键有关,物质的熔沸点与氢键有关.注意掌握杂化的理论应用.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
设NA为阿伏加德罗常数,下面叙述正确的是( )
| A、标准状况下,11.2L SO3所含分子数为0.5 NA |
| B、1L 1mol/L的氯化钠溶液中,所含离子数为NA |
| C、64g二氧化硫含有原子数为3NA |
| D、在反应中,1mol镁转化为Mg2+后失去的电子数为NA |
下列关于杂化轨道的叙述中,错误的是( )
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、气体单质中(除稀有气体),一定有σ键,可能有π键 |
| C、杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D、sp3、sp2、sp杂化轨道的夹角分别一定为109°28′、120°、180° |
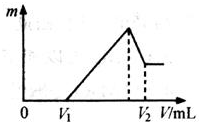 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: