题目内容
设 NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、16g CH4中含有10NA个电子 |
| B、1mol?L-1NaCl溶液含有NA个Na+ |
| C、1mol Cu和足量稀硝酸反应产生NA个NO分子 |
| D、常温常压下,22.4L CO2中含有NA个CO2分子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=
并结合甲烷的电子数目来分析计算;
B、不知溶液的体积,故无法计算微粒的数目;
C、根据化学方程式来计算;
D、常温常压下,气体摩尔体积不是22.4L/mol.
| m |
| M |
B、不知溶液的体积,故无法计算微粒的数目;
C、根据化学方程式来计算;
D、常温常压下,气体摩尔体积不是22.4L/mol.
解答:
解:A、16g CH4的物质的量n=
=
=1mol,而根据甲烷的分子式CH4可知,1molCH4含有10mol电子,故16g CH4的含有10mol电子即10NA个电子,故A正确;
B、不知溶液的体积,故无法计算Na+的物质的量以及数目,故B错误;
C、根据Cu和足量稀硝酸反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可知,1molCu生成
molNO,即
NA个NO分子,故C错误;
D、常温常压下,气体摩尔体积不是22.4L/mol,故22.4L CO2的物质的量不是1mol,故CO2分子个数不是NA个,故D错误.
故选A.
| m |
| M |
| 16g |
| 16g/mol |
B、不知溶液的体积,故无法计算Na+的物质的量以及数目,故B错误;
C、根据Cu和足量稀硝酸反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O可知,1molCu生成
| 2 |
| 3 |
| 2 |
| 3 |
D、常温常压下,气体摩尔体积不是22.4L/mol,故22.4L CO2的物质的量不是1mol,故CO2分子个数不是NA个,故D错误.
故选A.
点评:本题考查了有关阿伏伽德罗常数的计算,熟练掌握公式的使用和物质的结构是解题的关键.难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列关于杂化轨道的叙述中,错误的是( )
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、气体单质中(除稀有气体),一定有σ键,可能有π键 |
| C、杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D、sp3、sp2、sp杂化轨道的夹角分别一定为109°28′、120°、180° |
证明某溶液只含有Fe2+而不含有Fe3+的实验方法是( )
| A、先滴加氯水,再滴加KSCN溶液后显红 |
| B、只需滴加KSCN溶液 |
| C、先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| D、加Na2O2固体后观察沉淀颜色的变化 |
下列化学用语正确的是( )
A、Cl-的结构示意图: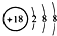 | ||
| B、光导纤维主要成分的化学式:Si | ||
| C、1H2、2H2、3H2互为同位素 | ||
D、质子数为53,中子数为78的碘原子:
|
下列说法或表示方法中正确的是( )
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ/mol |
| C、测定中和热的实验中,NaOH要稍过量,以使HCl完全中和 |
| D、Ba(OH)2?8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 |
已知:N2O4(g)?2NO2(g)△H=+52.70kJ?mol-1.在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是( )
| A、若再向容器内继续通入少量N2O4,则平衡向正反应方向移动 |
| B、新平衡时,NO2的体积分数小于原平衡时NO2的体积分数 |
| C、新平衡时,容器中气体的平均相对分子质量比原平衡大 |
| D、新平衡时,混合气体颜色变浅,容器中气体的密度增大 |
下列关于物质的量的概念,正确的是( )
| A、物质的量表示物质的数量 |
| B、物质的量表示物质的数量和质量 |
| C、物质的量的单位是摩尔 |
| D、物质的量的单位是g/mol |