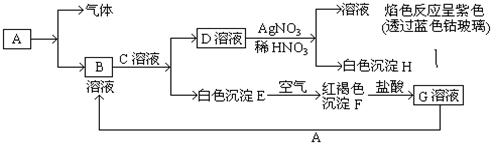
题目内容
在相同的状况下,等物质的量的下列各烃,分别在足量的氧气中燃烧,消耗氧气最多的是 ,生成二氧化碳最多的是 ;等质量的下列各烃在足量的氧气中燃烧消耗氧气最多的是 ,生成二氧化碳最多的是 .
A.CH4 B.C2H6 C.C2H2 D.C4H10.
A.CH4 B.C2H6 C.C2H2 D.C4H10.
考点:化学方程式的有关计算,有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:1mol烃CxHy的耗氧量为(x+
)mol,据此计算判断;根据C原子守恒,物质的量相等的各烃,分子中C原子数目越大,生成二氧化碳越多;
等质量的各烃,烃中H元素质量分数越大,消耗氧气越大,C元素质量分数越大,生成二氧化碳越多.
| y |
| 4 |
等质量的各烃,烃中H元素质量分数越大,消耗氧气越大,C元素质量分数越大,生成二氧化碳越多.
解答:
解:1molCxHy的耗氧量为(x+
)mol,由各烃分子式中C、H原子数目可知,相同物质的量各烃C4H10的耗氧量最大;根据C原子守恒,物质的量相等的各烃,分子中C原子数目越大,生成二氧化碳越多,故C4H10生成二氧化碳最多;
等质量的各烃,烃中H元素质量分数越大,消耗氧气越大,C元素质量分数越大,生成二氧化碳越多,CH4 、C2H6 、C2H2 、C4H10的C、H原子数目之比分别为1:4、1:3、1:1、1:2.5,故CH4中氢元素质量分数最大,等质量的各烃中CH4消耗氧气最多,C2H2中C元素质量分数最大,等质量的各烃中C2H2生成二氧化碳最多,
故答案为:C4H10;C4H10;CH4;C2H2.
| y |
| 4 |
等质量的各烃,烃中H元素质量分数越大,消耗氧气越大,C元素质量分数越大,生成二氧化碳越多,CH4 、C2H6 、C2H2 、C4H10的C、H原子数目之比分别为1:4、1:3、1:1、1:2.5,故CH4中氢元素质量分数最大,等质量的各烃中CH4消耗氧气最多,C2H2中C元素质量分数最大,等质量的各烃中C2H2生成二氧化碳最多,
故答案为:C4H10;C4H10;CH4;C2H2.
点评:本题考查有机物燃烧耗氧量与生成物量的有关问题,难度不大,注意根据燃烧通式及质量分数理解耗氧量问题.

练习册系列答案
相关题目
下列化学用语正确的是( )
A、Cl-的结构示意图: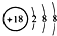 | ||
| B、光导纤维主要成分的化学式:Si | ||
| C、1H2、2H2、3H2互为同位素 | ||
D、质子数为53,中子数为78的碘原子:
|
 如图中A、B、C、D是短周期中同周期或同主族的相邻元素.
如图中A、B、C、D是短周期中同周期或同主族的相邻元素.