题目内容
在短周期元素中:
(1)与水反应最剧烈的金属是 ,化学方程式为 ;
(2)与水反应最剧烈的非金属单质是 ,化学方程式为 ;
(3)原子半径最小的元素是 ;气态氢化物最稳定的化学式是 ;
(4)最高价氧化物对应水化物的酸性最强的元素是 ,该酸化学式为 .
(1)与水反应最剧烈的金属是
(2)与水反应最剧烈的非金属单质是
(3)原子半径最小的元素是
(4)最高价氧化物对应水化物的酸性最强的元素是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)短周期中Na的金属性最强,与水反应最强剧烈,钠与水反应生成氢氧化钠与氢气;
(2)短周期中F元素非金属性最强,氟气与水反应最剧烈,氟气与水反应生成HF与氧气;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大;元素非金属性越强,其氢化物越稳定;
(4)氟元素没有最高含氧酸,故最高价氧化物对应水化物的酸性最强是高氯酸.
(2)短周期中F元素非金属性最强,氟气与水反应最剧烈,氟气与水反应生成HF与氧气;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大;元素非金属性越强,其氢化物越稳定;
(4)氟元素没有最高含氧酸,故最高价氧化物对应水化物的酸性最强是高氯酸.
解答:
解:(1)同周期自左而右金属性减弱、同主族自上而下金属性增强,故短周期中Na的金属性最强,与水反应最强剧烈,钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,故答案为:Na;2Na+2H2O=2NaOH+H2↑;
(2)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,短周期中F元素非金属性最强,F2与水反应最剧烈,氟气与水反应生成HF与氧气,反应方程式为:2F2+2H2O=4HF+O2,故答案为:F2;2F2+2H2O=4HF+O2;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,故短周期元素中H原子半径最小;F元素非金属性最强,故氢化物中HF最稳定,故答案为:H;HF;
(4)氟元素没有最高含氧酸,故Cl元素最高价氧化物对应水化物的酸性最强,其化学式是HClO4,故答案为:Cl;HClO4.
(2)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,短周期中F元素非金属性最强,F2与水反应最剧烈,氟气与水反应生成HF与氧气,反应方程式为:2F2+2H2O=4HF+O2,故答案为:F2;2F2+2H2O=4HF+O2;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,故短周期元素中H原子半径最小;F元素非金属性最强,故氢化物中HF最稳定,故答案为:H;HF;
(4)氟元素没有最高含氧酸,故Cl元素最高价氧化物对应水化物的酸性最强,其化学式是HClO4,故答案为:Cl;HClO4.
点评:本题考查元素周期律,难度不大,注意理解掌握同周期、同主族元素性质递变规律.

练习册系列答案
相关题目
下列关于杂化轨道的叙述中,错误的是( )
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、气体单质中(除稀有气体),一定有σ键,可能有π键 |
| C、杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D、sp3、sp2、sp杂化轨道的夹角分别一定为109°28′、120°、180° |
已知:N2O4(g)?2NO2(g)△H=+52.70kJ?mol-1.在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是( )
| A、若再向容器内继续通入少量N2O4,则平衡向正反应方向移动 |
| B、新平衡时,NO2的体积分数小于原平衡时NO2的体积分数 |
| C、新平衡时,容器中气体的平均相对分子质量比原平衡大 |
| D、新平衡时,混合气体颜色变浅,容器中气体的密度增大 |
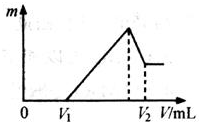 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: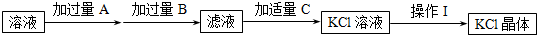
 过硫酸:
过硫酸:
 (b)
(b) (c)H2O2(d)
(c)H2O2(d) (e)
(e)
 (g)O3 (h)
(g)O3 (h)