题目内容
7.常温下,向20ml 0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示.则下列说法正确的是( )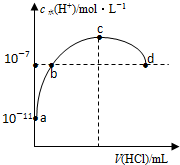
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
分析 A.b、d点溶液中c(H+)=10-5mol/L,常温下c(H+).c(OH-)=Kw=10-14,所以c(H+)=c(OH-),溶液呈中性;
B.根据图知,c点c(H+)>10-7mol/L,c(OH-)<10-7mol/L,溶液呈酸性,结合电荷守恒判断c(NH4+)、c(Cl-)相对大小;
C.a、b之间的任意一点,溶液都呈碱性,结合电荷守恒判断离子浓度大小.
D.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$ mol/L=0.001mol/L,Ka=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$.
解答 解:A.b、d点溶液中c(H+)=10-7mol/L,常温下c(H+).c(OH-)=Kw=10-14,所以c(H+)=c(OH-),溶液呈中性,如果氨水和盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,故A错误;
B.根据图知,c点c(H+)>10-7mol/L,c(OH-)<10-7mol/L,溶液呈酸性,结合电荷守恒得c(NH4+)<c(Cl-),故B错误;
C.a、b之间的任意一点,溶液都呈碱性,即c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),故C错误.
D.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$ mol/L=0.001mol/L,Ka=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$mol/L=1×10-5mol/L,故D正确;
故选D.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生分析判断及识图能力,明确图中曲线变化趋势及每一点溶液中溶质成分及其性质是解本题关键,注意电荷守恒的灵活运用,题目难度中等.


| A. | 25℃时Kb(NH3•H2O)≈10-5 | |
| B. | 滴定过程中水的电离程度一直保持增大趋势 | |
| C. | 为使终点现象更加明显可多加上几滴甲基橙 | |
| D. | 滴定终点时c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
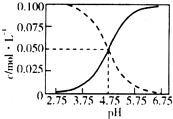 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )| A. | 25℃时,CH3COOH的电离常数K的值5×10-2.75 | |
| B. | 随pH增大,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| C. | pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
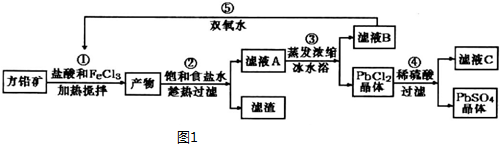
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2C1-(aq)?PbCl42-(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7.
(1)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是抑制Fe3+的水解.
反应过程中可观察到淡黄色沉淀,则①对应的离子方程式为2Fe3++PbS=PbCl2+S+2Fe2+.
(2)②所得的滤液A蒸发浓缩后再用冰水浴的目的是用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出(请用平衡移动原理解释)
(3)④中对应反应的平衡常数表达式$\frac{{c}^{2}(C{l}^{-})}{c(S{{O}_{4}}^{2-})}$.
(4)上述流程中可循环利用的物质有FeCl3、HCl.
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的铅浓度分数x与溶液pH变化的关系如图2所示:
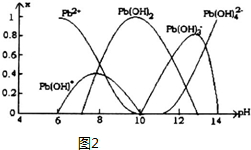
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为Pb(OH)3-+HO-=Pb(OH)42-..
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+?D2Pb(s)+2H+,则脱铅时最合适的pH约为6.