题目内容
12.含硫的物质与人们的生活密切相关.以下是硫及其化合物转化的一部分: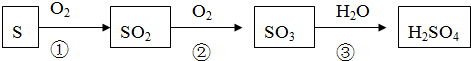
(1)通常状况下,硫单质的颜色是黄色.
(2)上述转化①②③中,不是氧化还原反应的是③(填序号).
(3)反应②的化学方程式是2SO2+O2$?_{△}^{催化剂}$2SO3.
(4)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的最终成分主要是H2SO4.
分析 (1)通常状况下,硫单质的颜色是淡黄色;
(2)上述转化①硫转化为二氧化硫是氧化还原反应;②二氧化硫转化为三氧化硫是氧化还原反应;③三氧化硫与水反应生成硫酸非氧化还原反应;
(3)二氧化硫转化为三氧化硫反应的化学方程式是2SO2+O2 $?_{△}^{催化剂}$ 2SO3;
(4)二氧化硫与水反应生成亚硫酸,亚硫酸被氧化成硫酸,所以由二氧化硫形成的酸雨的最终成分主要是H2SO4.
解答 解:(1)通常状况下,硫单质的颜色是淡黄色,故答案为:黄色;
(2)上述转化①硫转化为二氧化硫是氧化还原反应;②二氧化硫转化为三氧化硫是氧化还原反应;③三氧化硫与水反应生成硫酸非氧化还原反应,故选:③;
(3)二氧化硫转化为三氧化硫反应的化学方程式是2SO2+O2 $?_{△}^{催化剂}$ 2SO3,故答案为:2SO2+O2 $?_{△}^{催化剂}$ 2SO3;
(4)二氧化硫与水反应生成亚硫酸,亚硫酸被氧化成硫酸,所以由二氧化硫形成的酸雨的最终成分主要是H2SO4,故答案为:H2SO4.
点评 本题考查含硫物质及其性质,把握S元素的价态及性质的关系为解答的关键,注意含硫物质与环境、生活的关系,注重了化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 电离平衡常数(K)越小,表示弱电解质电离能力越弱 | |
| B. | BaSO4难溶于水,但它是强电解质,氨水是弱电解质 | |
| C. | 强电解质是离子化合物,弱电解质是共价化合物 | |
| D. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明氨水电离处于平衡状态 |
7.常温下,向20ml 0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示.则下列说法正确的是( )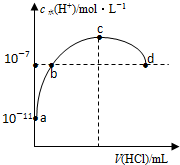

| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
17.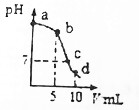 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
1.下列有关用惰性电极电解CuSO4溶液一段时间后的说法正确的是( )
| A. | 电解过程中阳极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Cu2O固体可使溶液恢复到电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |

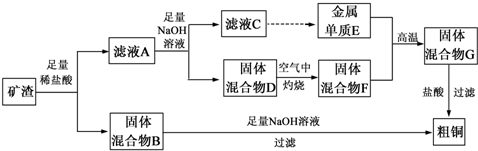
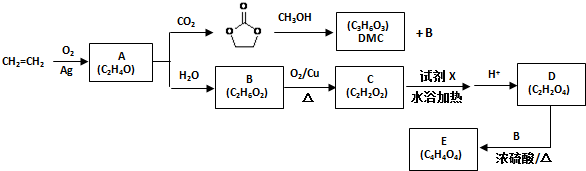
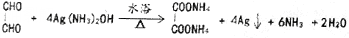 .
.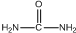 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式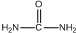 +2CH3OH$→_{△}^{催化剂}$
+2CH3OH$→_{△}^{催化剂}$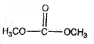 +2NH3↑.
+2NH3↑.