题目内容
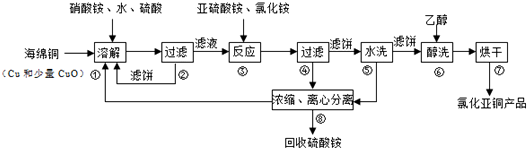
18.实验室用固体烧碱配制480mL0.1mol/L的NaOH溶液.步骤如下:①将氢氧化钠加适量蒸馏水溶解,冷却至室温
②计算实验所需的烧碱是2.0g
③将所得溶液转移到500mL的容量瓶中.
④然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1-2cm处.改用胶头滴管加蒸馏水到瓶颈刻度的地方
⑤用少量蒸馏水洗涤2~3次并将洗涤液全部转移到容量瓶中
⑥称量氢氧化钠固体,用来称量的仪器是托盘天平和烧杯.
⑦振荡、摇匀后,装瓶、贴签.
回答下列问题:
(1)实验正确的操作顺序为:②⑥①③⑤④⑦
(2)按题中序号填写其空白的地方②2.0③500 ④1-2cm、胶头滴管⑥托盘天平
(3)以下仪器中,属于配制过程中不需要的仪器有(填写代号)BE
A、烧杯 B、量筒 C、玻璃棒 D、容量瓶 E、漏斗
(4)如果实验按下面的操作进行则会对实验产生怎样的影响?(填偏高、偏低或无影响)
A、转移前,容量瓶中含有少量蒸馏水无影响
B、定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线偏低
C、定容时,俯视标线偏高.
分析 (1)根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签排序;
(2)②依据m=CVM计算需要溶质的质量;
③依据配制溶液体积选择合适规格的容量瓶;
④依据定容的正确操作解答;
⑥称量固体用托盘天平;
(3)根据实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签以及每步操作需要仪器确定反应所需仪器;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)配制一定物质的量浓度溶液一般步骤为:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,所以正确的顺序为:②⑥①③⑤④⑦;
故答案为:②⑥①③⑤④⑦;
(2)②用固体烧碱配制480mL0.1mol/L的NaOH溶液,应选择500mL容量瓶,需要溶质的质量=0.1mol/L×0.5L×40g/mol=2.0g;
故答案为:2.0g;
③配制480mL0.1mol/L的NaOH溶液,实验室没有480mL容量瓶,应选择500mL容量瓶;
故答案为:500;
④定容时,缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1-2cm处.改用胶头滴管加蒸馏水到瓶颈刻度的地方;
故答案为:1-2cm、胶头滴管;
⑥称量固体用托盘天平;
故答案为:托盘天平;
(3)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,配制过程中,不需要的仪器为量筒和漏斗;
故答案为:BE;
(4)A、转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,
故答案为:无影响;
B、定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;
C、定容时,俯视标线,导致溶液体积偏小,溶液浓度偏高,
故答案为:偏高;
点评 本题考查了一定物质的量浓度溶液的配制过程、仪器以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

 阅读快车系列答案
阅读快车系列答案| A. | 核磁共振 | B. | 红外光谱 | C. | 同位素示踪法 | D. | 质谱法 |
| A. | 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 室温下,pH=3的氢氟酸加水稀释后,溶液pH减小 | |
| C. | 室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
| A. | 电离平衡常数(K)越小,表示弱电解质电离能力越弱 | |
| B. | BaSO4难溶于水,但它是强电解质,氨水是弱电解质 | |
| C. | 强电解质是离子化合物,弱电解质是共价化合物 | |
| D. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明氨水电离处于平衡状态 |
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是D.
A.c(OH-)/c(H+) B.c(H+)•c(OH-)
C. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ D.c(H+)
E.c(H+)/c(CH3COOH)
(3)现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,相同条件下,取等体积的甲、乙两种溶液,各稀释100倍,稀释后的溶液,其pH大小关系应为:pH(甲)>pH(乙) ( 填“>”、“<”或“=”).
(4)现有常温下0.01mol/L盐酸丙和0.01mol/L醋酸溶液丁,相同条件下,取等体积的丙、丁两种溶液,各稀释100倍,稀释后的溶液,其pH大小关系应为:
pH(丙)小于pH(丁) ( 填“大于”、“小于”或“等于”).
(5)写出下列反应的离子方程式:
?CH3COOH+Na2CO3(少量):?2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑
?HCN+Na2CO3(少量):?HCN+CO32-=CN-+HCO3-
?NaCN+CO2(少量):?CN-+CO2+H2O=HCN+HCO3-
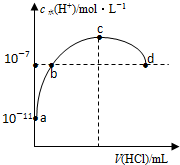
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |