题目内容
3.称取邻苯二甲酸氢钾0.7159g,用Na0H溶液滴定耗去34.95ml,计算Na0H溶液的浓度.分析 KHC8H4O4+NaOH=KNaC8H4O4+H2O,根据反应方程式,结合n=cV进行计算求解.
解答 解:邻苯二甲酸氢钾0.7159g物质的量=$\frac{0.7159g}{204.22g/mol}$=0.0035mol,依据方程式:KHC8H4O4+NaOH=KNaC8H4O4+H2O得:
KHC8H4O4+NaOH=KNaC8H4O4+H2O
1 1
0.0035mol C×0.03495L
则0.0035mol=C×0.03495L,解得C=1.0000mol/L;
答:Na0H溶液的浓度为1.0000mol/L;
点评 本题考查了有关物质的量的计算,准确写出反应方程式,找准物质之间的关系是解题关键,题目难度不大.

练习册系列答案
相关题目
13.把14.8g Na2CO3•10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中c(Na+)=1.2mol•L-1,若把等质量的固体混合物加热至恒重,残留固体质量是( )
| A. | 3.18g | B. | 6.36g | C. | 4.22g | D. | 5.28g |
14.化学测定有机物结构的分析方法很多,下列不属于测定有机物结构的分析方法的是( )
| A. | 核磁共振 | B. | 红外光谱 | C. | 同位素示踪法 | D. | 质谱法 |
11.下列各组物质中的最简式相同,但既不是同系物也不是同分异构体的是( )
| A. | CH2═CH2和 | B. | CH2═CH-CH2-CH3和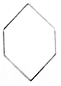 | ||
| C. | CH≡C-CH2-CH3和CH2═CH-CH═CH2 | D. | 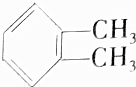 和 和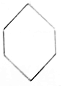 |
7.常温下,向20ml 0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示.则下列说法正确的是( )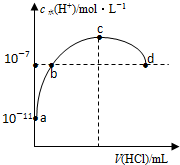

| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
