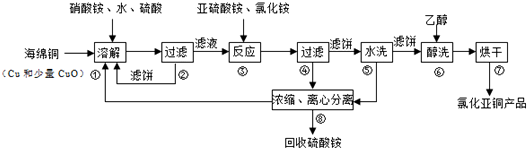
题目内容
16.某元素的原子序数为29,试问:(1)它有4个电子层
(2)有7个能级.
(3)它的价电子排布式是3d104s1.
(4)它属于第四周期第ⅠB族.
(5)它有1个未成对电子.
分析 根据核外电子排布原理,该元素的核外电子排布式应为1s22s22p63s23p63s104s1,共有29个电子,故为Cu元素.从核外电子排布式中可以得出n=4,有四个电子层,所以为第四周期元素,外围电子排布式为3d104s1,所以在第ⅠB族.外围电子的电子排布图为 ,所以有1个未成对电子,由此分析解答.
,所以有1个未成对电子,由此分析解答.
解答 解:根据核外电子排布原理,该元素的核外电子排布式应为1s22s22p63s23p63s104s1,共有29个电子,故为Cu元素.从核外电子排布式中可以得出n=4,有四个电子层,所以为第四周期元素,外围电子排布式为3d104s1,所以在第ⅠB族.外围电子的电子排布图为 ,所以有1个未成对电子,
,所以有1个未成对电子,
(1)它有 4个电子层,故答案为:4;
(2)有1s、2s、2p、3s、3p、3s、4s七个能级,故答案为:7;
(3)它的价电子排布式是3d104s1,故答案为:3d104s1;
(4)它属于第四周期第ⅠB族,故答案为:四;ⅠB;
(5)外围电子的电子排布图为 ,所以有1个未成对电子,它有 1个未成对电子,故答案为:1.
,所以有1个未成对电子,它有 1个未成对电子,故答案为:1.
点评 本题考查原子核外电子排布,解答该题需要掌握原子核外电子排布与元素周期表的关系和原子核外电子排布的规律,比较容易.

练习册系列答案
相关题目
7.常温下,向20ml 0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示.则下列说法正确的是( )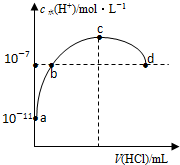

| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
1.下列有关用惰性电极电解CuSO4溶液一段时间后的说法正确的是( )
| A. | 电解过程中阳极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Cu2O固体可使溶液恢复到电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
6.下列实验操作、实验现象和实验结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大量共存 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol/LCH3COONa溶液的pH | pH试纸都变成碱色 | 可以用pH试纸的颜色与标准比色卡比较,从而判断HClO和CH3COOH的酸性强弱 |
| D | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量Na2S溶液 | 开始有白色沉淀生成,后有黑色沉淀生成 | Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
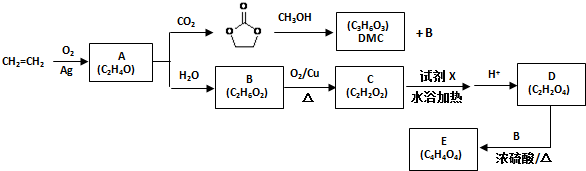
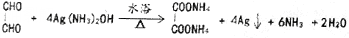 .
.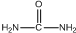 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式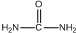 +2CH3OH$→_{△}^{催化剂}$
+2CH3OH$→_{△}^{催化剂}$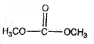 +2NH3↑.
+2NH3↑.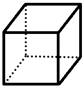 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.