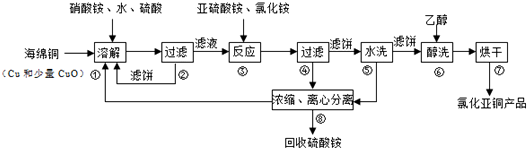
题目内容
19.硫酸铅,又名石灰浆,可用于铅蓄电池、纤维增重剂、涂料分析试剂.工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅.工艺流程如图1: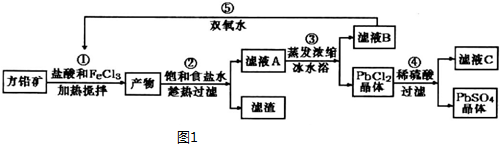
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5.
②PbCl2(s)+2C1-(aq)?PbCl42-(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7.
(1)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是抑制Fe3+的水解.
反应过程中可观察到淡黄色沉淀,则①对应的离子方程式为2Fe3++PbS=PbCl2+S+2Fe2+.
(2)②所得的滤液A蒸发浓缩后再用冰水浴的目的是用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出(请用平衡移动原理解释)
(3)④中对应反应的平衡常数表达式$\frac{{c}^{2}(C{l}^{-})}{c(S{{O}_{4}}^{2-})}$.
(4)上述流程中可循环利用的物质有FeCl3、HCl.
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的铅浓度分数x与溶液pH变化的关系如图2所示:
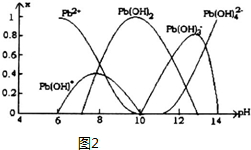
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为Pb(OH)3-+HO-=Pb(OH)42-..
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| 处理前浓度/(mg•L-1) | 0.100 | 29.8 | 0.12 | 0.087 |
| 处理后浓度/(mg•L-1) | 0.004 | 22.6 | 0.04 | 0.053 |
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+?D2Pb(s)+2H+,则脱铅时最合适的pH约为6.
分析 往方铅矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于PbCl2(s)+2Cl-(aq)?PbCl4-△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液A含有PbCl4-、Cl-、Fe2+、Fe3+等,滤液A蒸发浓缩,冷水浴中冷却,利用平衡逆向进行,析出PbCl2晶体,滤液B中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,滤液C中含有HCl.
(1)由Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7,分析加入盐酸的主要目的;
FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成;
(2)根据温度对平衡移动的影响进行分析;
(3)反应④的离子方程式为:PbCl2(s)+SO42-?PbSO4+2Cl-;
(4)过氧化氢将滤液B中Fe2+氧化为Fe3+,再循环利用,C溶液中含有HCl,也可以循环利用;
(5)①pH≥13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子结合为Pb(OH)42-;
②Ⅰ.计算Pb2+、Fe3+的浓度转化率进行判断;
Ⅱ.参加反应的是Pb2+,由图象可知,选择PH要使铅全部以Pb2+形式存在.
解答 解:往方铅矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于PbCl2(s)+2Cl-(aq)?PbCl4-△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液A含有PbCl4-、Cl-、Fe2+、Fe3+等,滤液A蒸发浓缩,冷水浴中冷却,利用平衡逆向进行,析出PbCl2晶体,滤液B中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,滤液C中含有HCl.
(1)Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7,流程中加入盐酸可以控制溶液的pH<1.9,主要目的是:抑制Fe3+的水解,
FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成,反应方程式为:2FeCl3+PbS=PbCl2+S+2FeCl2,反应离子方程式为:2Fe3++PbS=PbCl2+S+2Fe2+,
故答案为:抑制Fe3+的水解;2Fe3++PbS=PbCl2+S+2Fe2+;
(2)用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出,
故答案为:用冰水浴使PbCl2(s)+2Cl-(aq)?PbCl4-△H>0逆向移动,使PbCl4-转化PbCl2析出;
(3)反应④的离子方程式为:PbCl2(s)+SO42-?PbSO4+2Cl-,平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{c(S{{O}_{4}}^{2-})}$,
故答案为:$\frac{{c}^{2}(C{l}^{-})}{c(S{{O}_{4}}^{2-})}$;
(4)过氧化氢将滤液B中Fe2+氧化为Fe3+,再循环利用,C溶液中含有HCl,也可以循环利用,
故答案为:FeCl3、HCl;
(5)①pH≥13时,Pb(OH)3-浓度减小,Pb(OH)42-浓度增大,Pb(OH)3-与氢氧根离子结合为Pb(OH)42-,反应离子方程式为:Pb(OH)3-+HO-=Pb(OH)42-,
故答案为:Pb(OH)3-+HO-=Pb(OH)42-;
②Ⅰ.加入试剂,Pb2+的浓度转化率为$\frac{(0.1-0.004)}{0.1}$×1005%=96%,Fe3+的浓度转化率为$\frac{0.12-0.04}{0.12}$×100%=67%,所以去除Pb2+比Fe3+效果好,
故答案为:加入试剂,Pb2+的浓度转化率为$\frac{(0.1-0.004)}{0.1}$×1005%=96%,Fe3+的浓度转化率为$\frac{0.12-0.04}{0.12}$×100%=67%,所以去除Pb2+比Fe3+效果好;
Ⅱ.反应为2EH(s)+Pb2+?E2Pb(s)+2H+,参加反应的是Pb2+,由图象可知,选择PH要使铅全部以Pb2+形式存在,则脱铅时最合适的pH约6,
故答案为:6.
点评 本题考查物质制备实验方案,正确理解制备工艺流程为解答关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力,难度中等.

| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是D.
A.c(OH-)/c(H+) B.c(H+)•c(OH-)
C. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ D.c(H+)
E.c(H+)/c(CH3COOH)
(3)现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,相同条件下,取等体积的甲、乙两种溶液,各稀释100倍,稀释后的溶液,其pH大小关系应为:pH(甲)>pH(乙) ( 填“>”、“<”或“=”).
(4)现有常温下0.01mol/L盐酸丙和0.01mol/L醋酸溶液丁,相同条件下,取等体积的丙、丁两种溶液,各稀释100倍,稀释后的溶液,其pH大小关系应为:
pH(丙)小于pH(丁) ( 填“大于”、“小于”或“等于”).
(5)写出下列反应的离子方程式:
?CH3COOH+Na2CO3(少量):?2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑
?HCN+Na2CO3(少量):?HCN+CO32-=CN-+HCO3-
?NaCN+CO2(少量):?CN-+CO2+H2O=HCN+HCO3-
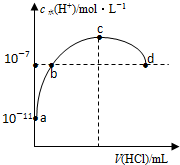
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
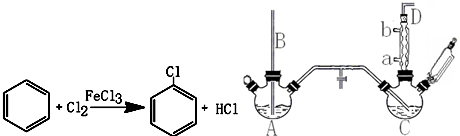
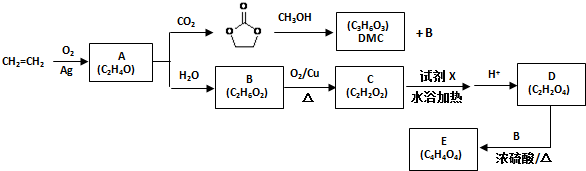
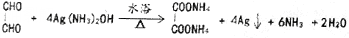 .
.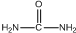 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式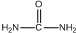 +2CH3OH$→_{△}^{催化剂}$
+2CH3OH$→_{△}^{催化剂}$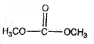 +2NH3↑.
+2NH3↑.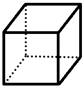 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.