题目内容
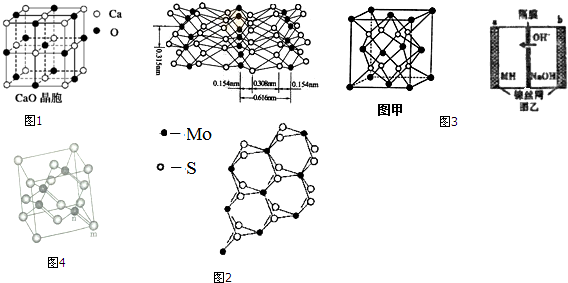
2. 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )| A. | 25℃时,CH3COOH的电离常数K的值5×10-2.75 | |
| B. | 随pH增大,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| C. | pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
分析 随碱性增强,溶液中c(CH3COOH)减小,c(CH3COO-)增大,虚线表示c(CH3COOH),实线表示c(CH3COO-).
A.由图可知,pH=4.75时,c(CH3COOH)=c(CH3COO-)=0.05mol/L,结合Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$计算;
B.由醋酸电离平衡常数可知:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c({H}^{+})}{{K}_{a}}$;
C.由图可知,pH=4时,c(CH3COOH)>c(CH3COO-);
D.由电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),而溶液中c(CH3COOH)+c(CH3COO-)=0.1mol•L-1.
解答 解:随碱性增强,溶液中c(CH3COOH)减小,c(CH3COO-)增大,虚线表示c(CH3COOH),实线表示c(CH3COO-).
A.由图可知,pH=4.75时,溶液中c(H+)=10-4.75mol/L,c(CH3COOH)=c(CH3COO-)=0.05mol/L,则CH3COOH的电离常数K=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=c(H+)=10-4.75mol/L,故A错误;
B.由醋酸电离平衡常数可知:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c({H}^{+})}{{K}_{a}}$,随pH增大,c(H+)减小,则$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小,故B错误;
C.由图可知,pH=4时,c(CH3COOH)>c(CH3COO-),故C错误;
D.由电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),而溶液中c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,联立可得c(Na+)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol•L-1,故D正确.
故选:D.
点评 本题考查离子浓度大小比较、电离平衡常数、pH有关计算等,关键是明确图象中曲线变化含义,注意掌握电荷守恒、物料守恒、质子守恒及盐的水解原理在判断离子浓度大小中的应用,难度中等.

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 室温下,pH=3的氢氟酸加水稀释后,溶液pH减小 | |
| C. | 室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是D.
A.c(OH-)/c(H+) B.c(H+)•c(OH-)
C. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ D.c(H+)
E.c(H+)/c(CH3COOH)
(3)现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,相同条件下,取等体积的甲、乙两种溶液,各稀释100倍,稀释后的溶液,其pH大小关系应为:pH(甲)>pH(乙) ( 填“>”、“<”或“=”).
(4)现有常温下0.01mol/L盐酸丙和0.01mol/L醋酸溶液丁,相同条件下,取等体积的丙、丁两种溶液,各稀释100倍,稀释后的溶液,其pH大小关系应为:
pH(丙)小于pH(丁) ( 填“大于”、“小于”或“等于”).
(5)写出下列反应的离子方程式:
?CH3COOH+Na2CO3(少量):?2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑
?HCN+Na2CO3(少量):?HCN+CO32-=CN-+HCO3-
?NaCN+CO2(少量):?CN-+CO2+H2O=HCN+HCO3-
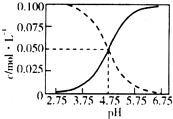
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
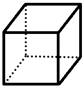 “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.
“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图所示.