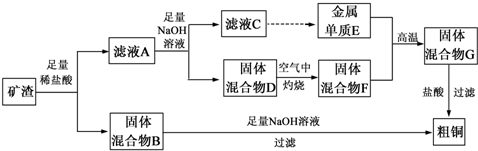
题目内容
15.25℃时,取浓度为0.1000mol•L-1的氨水20.00mL,用0.1000mol•L-1盐酸滴定,过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
| A. | 25℃时Kb(NH3•H2O)≈10-5 | |
| B. | 滴定过程中水的电离程度一直保持增大趋势 | |
| C. | 为使终点现象更加明显可多加上几滴甲基橙 | |
| D. | 滴定终点时c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
分析 A.根据图知,未加HCl时氨水pH=11,则氨水中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,氨水溶液中c(NH4+)≈c(OH-)=0.001mol/L,Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.指示剂能够与酸或者碱溶液反应,不能滴加过多的指示剂;
D.滴定终点时,溶液由黄色变为红色,溶液呈酸性,再结合电荷守恒判断离子浓度大小.
解答 解:A.根据图知,未加HCl时氨水pH=11,则氨水中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,氨水溶液中c(NH4+)≈c(OH-)=0.001mol/L,Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{0.001×0.001}{0.1000}$10-5,故A正确;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,所以开始时氨水抑制水电离,随着HCl的滴加,溶液中铵根离子浓度增大,碱性减弱,水的电离程度增大,当二者恰好完全反应时水的电离程度最大,继续滴加盐酸,溶液呈酸性,抑制水电离,故B错误;
C.由于指示剂能够与酸或者碱溶液反应,在中和滴定时不能滴加过多的指示剂,否则会影响测定结果,故C错误;
D.滴定终点时,溶液由黄色变为红色,溶液呈酸性,再结合电荷守恒得c(NH4+)<c(Cl-),溶液中氢离子浓度较小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D错误;
故选A.
点评 本题考查弱电解质的电离和酸碱混合溶液定性判断,为高频考点,侧重考查学生识图及分析计算能力,明确曲线变化趋势及每一点对应的溶质成分是解本题关键,难点是计算一水合氨电离平衡常数,注意等量代换,题目难度不大.

| A. | CH2═CH2和 | B. | CH2═CH-CH2-CH3和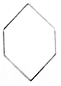 | ||
| C. | CH≡C-CH2-CH3和CH2═CH-CH═CH2 | D. | 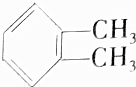 和 和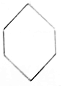 |
| A. | 电离平衡常数(K)越小,表示弱电解质电离能力越弱 | |
| B. | BaSO4难溶于水,但它是强电解质,氨水是弱电解质 | |
| C. | 强电解质是离子化合物,弱电解质是共价化合物 | |
| D. | 氨气溶于水,当c(OH-)=c(NH4+)时,表明氨水电离处于平衡状态 |
| ① | HF | Ka=6.8×10-4 mol•L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol•L-1 |
| ③ | HCN | Ka=6.2×10-10 mol•L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是D.
A.c(OH-)/c(H+) B.c(H+)•c(OH-)
C. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ D.c(H+)
E.c(H+)/c(CH3COOH)
(3)现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,相同条件下,取等体积的甲、乙两种溶液,各稀释100倍,稀释后的溶液,其pH大小关系应为:pH(甲)>pH(乙) ( 填“>”、“<”或“=”).
(4)现有常温下0.01mol/L盐酸丙和0.01mol/L醋酸溶液丁,相同条件下,取等体积的丙、丁两种溶液,各稀释100倍,稀释后的溶液,其pH大小关系应为:
pH(丙)小于pH(丁) ( 填“大于”、“小于”或“等于”).
(5)写出下列反应的离子方程式:
?CH3COOH+Na2CO3(少量):?2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑
?HCN+Na2CO3(少量):?HCN+CO32-=CN-+HCO3-
?NaCN+CO2(少量):?CN-+CO2+H2O=HCN+HCO3-
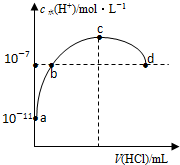
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
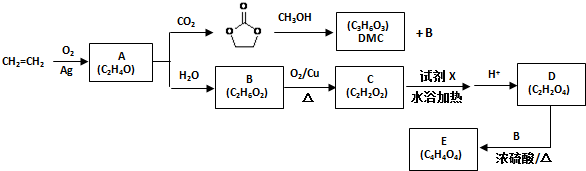
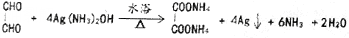 .
.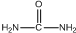 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式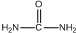 +2CH3OH$→_{△}^{催化剂}$
+2CH3OH$→_{△}^{催化剂}$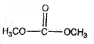 +2NH3↑.
+2NH3↑.