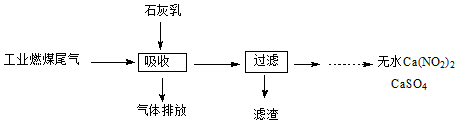
题目内容
2.选择下列一种方法分离物质,将分离方法的序号填在横线上.A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)从溴水中提取溴A;
(2)从含有少量氯化钠的硝酸钾混合液中获得硝酸钾C;
(3)分离水和汽油的混合物D;
(4)分离晶体碘和铁屑B.
分析 (1)溴不易溶于水,易溶于有机溶剂;
(2)二者的溶解度受温度影响不同;
(3)水和汽油的混合物,分层;
(4)碘易升华.
解答 解:(1)溴不易溶于水,易溶于有机溶剂,则选萃取分液法从溴水中提取溴,故答案为:A;
(2)二者的溶解度受温度影响不同,则选择结晶法从含有少量氯化钠的硝酸钾混合液中获得硝酸钾,故答案为:C;
(3)水和汽油的混合物,分层,则选择分液法分离,故答案为:D;
(4)碘易升华,可加热分离,为升华操作,故答案为:B.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同为解答该题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列说法中正确的是( )
| A. | 氯化钾溶液在电流作用下电离成K+和Cl- | |
| B. | 摩尔是表示物质所含微粒集体是多少的物理量 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 氧化还原反应的本质是有电子的转移 |
7.下列实验中,对应的现象以及实验目的都正确的是( )
| 选项 | 目的 | 实验 | 现象 |
| A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
| B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
| C | 比较氯和碳的非金属性强弱 | 将碳酸钠溶液中滴入稀盐酸 | 有气泡产生 |
| D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L-1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法中不正确的是( )
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | NO2溶于水时发生氧化还原反应 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
11.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H<0
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s),CO的平衡转化率为25%.(结果均保留两位有效数字)
(2)写出该反应的平衡常数K的表达式K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$.
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.某同学设计了三组实验,实验条件已经填在下面实验设计表中.
①以上三组实验的实验目的是分别验证温度、催化剂比表面积对化学反应速率的影响规律.
②请在给出的坐标图中,画出上表中的第三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图.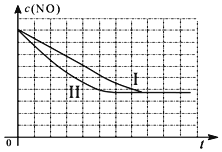
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s),CO的平衡转化率为25%.(结果均保留两位有效数字)
(2)写出该反应的平衡常数K的表达式K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$.
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.某同学设计了三组实验,实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
②请在给出的坐标图中,画出上表中的第三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图.

6.表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为 ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl;
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=Br2+2NaCl.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na,原子半径最小的是Cl;
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=Br2+2NaCl.