题目内容
11.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H<0为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s),CO的平衡转化率为25%.(结果均保留两位有效数字)
(2)写出该反应的平衡常数K的表达式K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$.
(3)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.某同学设计了三组实验,实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
②请在给出的坐标图中,画出上表中的第三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图.

分析 (1)前2s内的平均反应速率υ(CO)=$\frac{(3.60-2.85)×1{0}^{-3}mol/L}{2s}$=0.375mol/(L.s),根据同一段时间内各物质的反应速率之比等于其计量数之比计算υ(N2);
参加反应的c(CO)=(3.60-2.70)×10-3mol/L,CO转化率=$\frac{参加反应的c(CO)}{反应初始c(CO)}$×100%;
(2)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(3)该反应是一个反应前后气体体积减小的放热反应,增大压强、降低温度、增大NO浓度、减小生成物浓度都能增大CO转化率;
(4)①利用控制变量法分析解答,Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响,Ⅱ、Ⅲ的催化剂比表面积相同,研究的是温度对速率的影响,Ⅰ、Ⅲ催化剂的比表面积不同,温度不同,研究温度、催化剂的比表面积对反应速率的影响;
②绘图时,要注意达平衡的时间、平衡浓度的相对大小:Ⅱ与Ⅰ温度相同,平衡不移动,平衡浓度相同,但Ⅱ催化剂比表面积增大,达平衡时间短;
Ⅲ与Ⅱ的催化剂比表面积相同,Ⅲ温度高,温度升高,不仅达平衡时间缩短,平衡向左移动,使NO的平衡浓度也增大.
解答 解:(1)前2s内的平均反应速率υ(CO)=$\frac{(3.60-2.85)×1{0}^{-3}mol/L}{2s}$=0.375 mol/(L.s),根据同一段时间内各物质的反应速率之比等于其计量数之比得υ(N2)=$\frac{1}{2}$υ(CO)=$\frac{1}{2}$×0.375 mol/(L.s)=1.875×10-4mol/(L•s),
参加反应的c(CO)=(3.60-2.70)×10-3mol/L,CO转化率=$\frac{参加反应的c(CO)}{反应初始c(CO)}$×100%=$\frac{(3.60-2.70)×1{0}^{-3}mol/L}{3.60×1{0}^{-3}mol/L}×100%$=25%;
故答案为:1.875×10-4mol/(L•s);25%;
(2)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$,
故答案为:K=$\frac{{c}^{2}(C{O}_{2}).c({N}_{2})}{{c}^{2}(NO).{c}^{2}(CO)}$;
(3)A.选用更有效的催化剂只改变化学反应速率,不影响平衡移动,则不能提高CO转化率,故A错误;B.升高反应体系的温度,平衡逆向移动,降低CO转化率,故B错误;
C.降低反应体系的温度,平衡正向移动,提高CO转化率,故C正确;
D.缩小容器的体积,增大压强平衡正向移动,提高CO转化率,故D正确;
故选CD;
(4)①利用控制变量法分析解答,Ⅰ、Ⅱ研究的是催化剂的比表面积对速率的影响,Ⅱ、Ⅲ的催化剂比表面积相同,研究的是温度对速率的影响,Ⅰ、Ⅲ催化剂的比表面积不同,温度不同,研究温度、催化剂的比表面积对反应速率的影响,故目的是:分别验证温度、催化剂比表面积对化学反应速率的影响规律,
故答案为:分别验证温度、催化剂比表面积对化学反应速率的影响规律;
②Ⅱ与Ⅰ温度相同,平衡不移动,平衡浓度相同,但Ⅱ催化剂比表面积增大,达平衡时间短,
Ⅲ与Ⅱ的催化剂比表面积相同,Ⅲ温度高,温度升高,不仅达平衡时间缩短,平衡向左移动,使NO的平衡浓度也增大,三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为: ,
,
故答案为: .
.
点评 本题考查化学平衡的计算、化学平衡常数、平衡移动影响因素、影响速率因素探究实验等,为高频考点,侧重考查学生分析判断计算能力,(4)中注意利用控制变量法分析解答,题目难度中等.

| A. | 过氧化钠的电子式: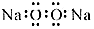 | B. | 次氯酸钠的结构式:H-Cl-OC | ||
| C. | 氯化铵的电子式: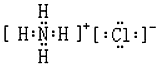 | D. | 硫离子的结构示意图: |