题目内容
将15%的NaOH溶液蒸发掉100g水后得到125ml质量分数为30%的NaOH溶液,则此时溶液的物质的量浓度为( )
| A、6 mol?L-1 |
| B、6.25 mol?L-1 |
| C、6.75 mol?L-1 |
| D、7 mol?L-1 |
考点:物质的量浓度的相关计算
专题:
分析:根据蒸发前后溶质的质量不变,据此计算出蒸发前溶液的质量,根据质量分数计算溶质的物质的量,再根据n=
、c=
计算蒸发后溶液的物质的量浓度.
| m |
| M |
| n |
| V |
解答:
解:设15%的NaOH溶液的质量为x,蒸发前后溶质的质量不变,则有x×15%=(x-100g)×30%,解得x=200g,
故蒸发后溶液的质量为:200g-100g=100g,
故30%的NaOH溶液中含有NaOH的物质的量为:n=
=
=0.75mol,
所得溶液的物质的量浓度为:c=
=
=6mol/L,
故选A.
故蒸发后溶液的质量为:200g-100g=100g,
故30%的NaOH溶液中含有NaOH的物质的量为:n=
| m |
| M |
| 100×30% |
| 40g/mol |
所得溶液的物质的量浓度为:c=
| n |
| V |
| 0.75mol |
| 0.125L |
故选A.
点评:本题考查了物质的量浓度的简单计算,题目难度不大,注意掌握物质的量浓度的概念及计算方法,明确物质的量与物质的量浓度、摩尔质量之间的关系.

练习册系列答案
相关题目
对于反应2NO2(g)?N2O4(g)达到平衡后,在温度不变时欲使
比值增大,可以采取( )
| c(NO2) |
| c(N2O4) |
| A、体积不变,增加NO2的量 |
| B、体积不变,增加N2O4的量 |
| C、使体积扩大到原来的2倍 |
| D、使体积不变充入N2 |
做焰色反应实验用的铂丝,每次实验后必须进行的操作是( )
| A、用水洗涤2~3次 |
| B、用盐酸洗涤后,再用蒸馏水冲洗 |
| C、用滤纸擦拭干 |
| D、用盐酸洗涤后,再在酒精灯火焰上灼烧到没有其它颜色 |
K35ClO3晶体与H37Cl浓溶液发生反应生成氯气、氯化钾和水.则此反应生成的氯气的相对分子质量为( )
| A、70.6 | B、73 |
| C、73.3 | D、74 |
张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值.这是相对原子质量表中首次采用我国测定的相对原子质量值.则下列关于
In的说法中,错误的是( )
115 49 |
A、
| ||
B、
| ||
C、
| ||
D、
|
下列关于气体摩尔体积的叙述中,正确的是( )
| A、1 mol任何气体的体积都约是22.4 L |
| B、标准状况时,氧气的体积约是22.4 L |
| C、1 molH2和1 molH2O在标准状况下体积都约是22.4 L |
| D、1 mol任何气体在标准状况下所占体积都约是22.4 L |
能正确表示下列反应的离子方程式是( )
| A、钠投入水中:Na+H2O═Na++OH-+H2↑ |
| B、碳酸钙与醋酸反应:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
| C、少量碳酸氢钙溶液与足量氢氧化钠溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| D、铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag |
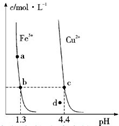 某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )
某温度下,Fe (OH)3(s)、Cu (OH)2 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是( )| A、Ksp〔Fe (OH)3〕<Ksp〔Cu (OH)2〕 |
| B、加适量NH4Cl固体可使溶液由a 点变到b点 |
| C、c、d两点代表的溶液中c(H+) 与c(OH-)乘积相等 |
| D、Fe (OH)3、Cu (OH)2分别在b、c两点代表的溶液中达到饱和 |
 某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)
某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)