题目内容
 某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)
某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)(1)由此可知,该溶液中肯定含有的离子是
(2)肯定不含的阳离子是
考点:离子方程式的有关计算
专题:
分析:从图中沉淀量随之氢氧化钠的加入量增加变化情况结合离子的性质可知:开始发生酸碱中和,然后Al3+与碱反应,再NH4+与碱反应,最后沉淀与碱反应完全溶解,依据各段发生反应消耗的氢氧化钠的物质的量计算各种离子的物质的量.
解答:
解:由图可知,开始发生酸碱中和,然后Al3+与碱反应,再NH4+与碱反应,最后沉淀与碱反应完全溶解,所以溶液中含有的离子有:H+,Al3+,NH4+,一定不含的离子为:Mg2+,Fe3+,
(1)过程中依次发生的反应为:H++OH-=H2O;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=[Al(OH)4]-;
则有图消耗氢氧化钠的物质的量可知:
H++OH-=H2O; Al3++3OH-=Al(OH)3↓; NH4++OH-=NH3?H2O;
1 1 1 3 1 1
n(H+) 2mol n(Al3+) 3mol n(NH4+)3mol
所以n(H+)=2mol; n(Al3+)=1mol;n(NH4+)=3mol;
n(H+):n(Al3+):n(NH4+)=2:1:3;
故答案为:H+,Al3+,NH4+;2:1:3;
(2)最后沉淀与碱反应完全溶解,而氢氧化镁、氢氧化铁在氢氧化钠中不溶解,故一定不含:Mg2+,Fe3+;
故答案为:Mg2+,Fe3+.
(1)过程中依次发生的反应为:H++OH-=H2O;Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=[Al(OH)4]-;
则有图消耗氢氧化钠的物质的量可知:
H++OH-=H2O; Al3++3OH-=Al(OH)3↓; NH4++OH-=NH3?H2O;
1 1 1 3 1 1
n(H+) 2mol n(Al3+) 3mol n(NH4+)3mol
所以n(H+)=2mol; n(Al3+)=1mol;n(NH4+)=3mol;
n(H+):n(Al3+):n(NH4+)=2:1:3;
故答案为:H+,Al3+,NH4+;2:1:3;
(2)最后沉淀与碱反应完全溶解,而氢氧化镁、氢氧化铁在氢氧化钠中不溶解,故一定不含:Mg2+,Fe3+;
故答案为:Mg2+,Fe3+.
点评:本题考查了离子的鉴别,题目难度不大,熟悉相关离子的性质、明确图象中各段的含义及发生的反应是解题关键,注意铝离子的性质.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
将15%的NaOH溶液蒸发掉100g水后得到125ml质量分数为30%的NaOH溶液,则此时溶液的物质的量浓度为( )
| A、6 mol?L-1 |
| B、6.25 mol?L-1 |
| C、6.75 mol?L-1 |
| D、7 mol?L-1 |
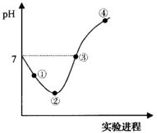 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的氢氧化钠溶液,整个过程中pH( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的氢氧化钠溶液,整个过程中pH( )| A、①点所示溶液中:c(H+)=c(Cl-)+c(ClO-) |
| B、②点所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) |
| C、③点所示溶液中:c(Na+)=c(HClO)+2c(ClO-) |
| D、④点所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
电解84.7mL质量分数为16%的氢氧化钠溶液(密度为1.18g?cm-3),过一段时间后,电解所得溶液中溶质的质量分数为19.5%(用石墨为电极),这是因为( )
| A、溶质增加了3.5 g |
| B、有1.5 mol水被电解 |
| C、在阳极生成2 g H2 |
| D、在阳极生成16 g O2 |
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: