题目内容
做焰色反应实验用的铂丝,每次实验后必须进行的操作是( )
| A、用水洗涤2~3次 |
| B、用盐酸洗涤后,再用蒸馏水冲洗 |
| C、用滤纸擦拭干 |
| D、用盐酸洗涤后,再在酒精灯火焰上灼烧到没有其它颜色 |
考点:焰色反应
专题:
分析:焰色反应最主要的就是无其他离子干扰,每次做完焰色反应实验后,铂丝会留有实验的物质,为除去实验物质用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用,盐酸可以溶解氧化物等杂质且易挥发,不会残留痕迹,所以选用盐酸洗涤.
解答:
解:A.用水洗涤,铂丝上残留的物质不能全部清除,对实验造成干扰,故A错误;
B.用盐酸洗涤,再用蒸馏水冲洗后使用,不能完全去除其它离子的干扰,故B错误;
C.用滤纸擦干净,铂丝上残留的物质不能全部清除,对实验造成干扰,故C错误;
D.用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用,去除了其它离子的干扰,且HCl受热以后会挥发,无残留,故D正确;
故选D.
B.用盐酸洗涤,再用蒸馏水冲洗后使用,不能完全去除其它离子的干扰,故B错误;
C.用滤纸擦干净,铂丝上残留的物质不能全部清除,对实验造成干扰,故C错误;
D.用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用,去除了其它离子的干扰,且HCl受热以后会挥发,无残留,故D正确;
故选D.
点评:本题考查了焰色反应实验,难度不大,根据教材基础知识解答即可;明确焰色反应是元素的性质,不是原子或离子的性质,洗涤用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
实验室欲用氯化钠固体配制500mL、0.10mol?L-1的NaCl溶液,下列叙述正确的是( )
| A、实验用到的仪器有:托盘天平、烧杯、1000mL容量瓶、玻璃棒 |
| B、将称量好的固体放入500mL容量瓶中溶解 |
| C、定容时若俯视刻度,则所得溶液浓度偏高 |
| D、定容后翻转摇匀,发现液面下降,又加入蒸馏水到刻度线 |
已知如下氧化还原反应2BrO3-+Cl2=Br2+2ClO3- 5Cl2+I2+6H2O=2HIO3+10HCl ClO3-+5Cl-+6H+=3Cl2+3H2O
则下列各微粒氧化能力强弱顺序正确的是( )
则下列各微粒氧化能力强弱顺序正确的是( )
| A、ClO3->BrO3->IO3->Cl2 |
| B、BrO3->Cl2>ClO3->IO3- |
| C、BrO3->ClO3->Cl2>IO3- |
| D、Cl2>BrO3->ClO3->IO3- |
加热NH4HCO3固体,使产生的气体依次通过盛有过量Na2O2的干燥管、浓H2SO4的洗气瓶,最后得到的气体是 ( )
| A、O2 |
| B、NH3 |
| C、CO2 |
| D、CO2和O2 |
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:下列说法不正确的是( )
mCeO2
(m-x)CeO2?xCe+xO2
(m-x)CeO2?Ce+xH2O+xCO2
mCeO2+xH2+xCO.
mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?Ce+xH2O+xCO2
| 900℃ |
| ② |
A、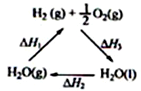 图中△H1=△H2+△H3 |
| B、该过程实现了太阳能向化学能的转化 |
| C、该过程中CeO2没有消耗 |
| D、H2O(l)=H2O(g)此过程中,△H>0 |
将15%的NaOH溶液蒸发掉100g水后得到125ml质量分数为30%的NaOH溶液,则此时溶液的物质的量浓度为( )
| A、6 mol?L-1 |
| B、6.25 mol?L-1 |
| C、6.75 mol?L-1 |
| D、7 mol?L-1 |
电解84.7mL质量分数为16%的氢氧化钠溶液(密度为1.18g?cm-3),过一段时间后,电解所得溶液中溶质的质量分数为19.5%(用石墨为电极),这是因为( )
| A、溶质增加了3.5 g |
| B、有1.5 mol水被电解 |
| C、在阳极生成2 g H2 |
| D、在阳极生成16 g O2 |
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: