题目内容
能正确表示下列反应的离子方程式是( )
| A、钠投入水中:Na+H2O═Na++OH-+H2↑ |
| B、碳酸钙与醋酸反应:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
| C、少量碳酸氢钙溶液与足量氢氧化钠溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| D、铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag |
考点:离子方程式的书写
专题:
分析:A.原子不守恒;
B.难溶物碳酸钙写化学式;
C.二者反应生成碳酸钙、水、碳酸钠;
D.二者发生置换反应生成铜离子和银.
B.难溶物碳酸钙写化学式;
C.二者反应生成碳酸钙、水、碳酸钠;
D.二者发生置换反应生成铜离子和银.
解答:
解:A.原子不守恒,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.难溶物碳酸钙写化学式,离子方程式为CaCO3+2CH3COOH═CO2↑+H2O+2CH3COO-+Ca2+,故B错误;
C.二者反应生成碳酸钙、水、碳酸钠,离子方程式为Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故C错误;
D.二者发生置换反应生成铜离子和银,离子方程式为Cu+2Ag+═Cu2++2Ag,故D正确;
故选D.
B.难溶物碳酸钙写化学式,离子方程式为CaCO3+2CH3COOH═CO2↑+H2O+2CH3COO-+Ca2+,故B错误;
C.二者反应生成碳酸钙、水、碳酸钠,离子方程式为Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故C错误;
D.二者发生置换反应生成铜离子和银,离子方程式为Cu+2Ag+═Cu2++2Ag,故D正确;
故选D.
点评:本题考查离子方程式正误判断,明确物质的性质及离子方程式书写规则是解本题关键,注意符合客观事实、原子守恒、电荷守恒及转移电子守恒,有的离子反应还与反应物的量、浓度有关,为易错点.

练习册系列答案
相关题目
已知如下氧化还原反应2BrO3-+Cl2=Br2+2ClO3- 5Cl2+I2+6H2O=2HIO3+10HCl ClO3-+5Cl-+6H+=3Cl2+3H2O
则下列各微粒氧化能力强弱顺序正确的是( )
则下列各微粒氧化能力强弱顺序正确的是( )
| A、ClO3->BrO3->IO3->Cl2 |
| B、BrO3->Cl2>ClO3->IO3- |
| C、BrO3->ClO3->Cl2>IO3- |
| D、Cl2>BrO3->ClO3->IO3- |
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:下列说法不正确的是( )
mCeO2
(m-x)CeO2?xCe+xO2
(m-x)CeO2?Ce+xH2O+xCO2
mCeO2+xH2+xCO.
mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?Ce+xH2O+xCO2
| 900℃ |
| ② |
A、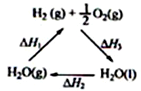 图中△H1=△H2+△H3 |
| B、该过程实现了太阳能向化学能的转化 |
| C、该过程中CeO2没有消耗 |
| D、H2O(l)=H2O(g)此过程中,△H>0 |
将15%的NaOH溶液蒸发掉100g水后得到125ml质量分数为30%的NaOH溶液,则此时溶液的物质的量浓度为( )
| A、6 mol?L-1 |
| B、6.25 mol?L-1 |
| C、6.75 mol?L-1 |
| D、7 mol?L-1 |
下列叙述中正确的是( )
| A、1molO2的质量为32g/mol |
| B、SO42- 的摩尔质量是96g/mol |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、二氧化碳的摩尔质量44g |
电解84.7mL质量分数为16%的氢氧化钠溶液(密度为1.18g?cm-3),过一段时间后,电解所得溶液中溶质的质量分数为19.5%(用石墨为电极),这是因为( )
| A、溶质增加了3.5 g |
| B、有1.5 mol水被电解 |
| C、在阳极生成2 g H2 |
| D、在阳极生成16 g O2 |

