题目内容
对于反应2NO2(g)?N2O4(g)达到平衡后,在温度不变时欲使
比值增大,可以采取( )
| c(NO2) |
| c(N2O4) |
| A、体积不变,增加NO2的量 |
| B、体积不变,增加N2O4的量 |
| C、使体积扩大到原来的2倍 |
| D、使体积不变充入N2 |
考点:化学平衡的影响因素
专题:
分析:A、体积不变,增加NO2,相当于增大压强,平衡右移,分析NO2、N2O4的物质的量变化情况,进行判断;
B、体积不变,增加N2O4,相当于增大压强,平衡右移,分析NO2、N2O4的物质的量变化情况,进行判断;
C、体积增大,相当于减压,平衡左移,分析NO2、N2O4的物质的量变化情况,进行判断;
D、充入N2,保持压强不变,体积增大,相当于减压,平衡左移,分析NO2、N2O4的物质的量变化情况,进行判断.
B、体积不变,增加N2O4,相当于增大压强,平衡右移,分析NO2、N2O4的物质的量变化情况,进行判断;
C、体积增大,相当于减压,平衡左移,分析NO2、N2O4的物质的量变化情况,进行判断;
D、充入N2,保持压强不变,体积增大,相当于减压,平衡左移,分析NO2、N2O4的物质的量变化情况,进行判断.
解答:
解:A、体积不变,增加NO2,相当于增大压强,平衡右移,NO2的物质的量减小,N2O4的物质的量增大,故
比值变小,故A错误;
B、体积不变,增加N2O4,相当于增大压强,平衡右移,NO2的物质的量减小,N2O4的物质的量增大,故
比值变小,故B错误;
C、体积增大,相当于减压,平衡左移,NO2的物质的量增大,N2O4的物质的量减小,故
比值变大,故C正确;
D、充入N2,保持体积不变,各物质的浓度不变,所以平衡不移动,故
比值不变,故D错误;
故选C.
| c(NO 2) |
| c(N 2O 4) |
B、体积不变,增加N2O4,相当于增大压强,平衡右移,NO2的物质的量减小,N2O4的物质的量增大,故
| c(NO 2) |
| c(N 2O 4) |
C、体积增大,相当于减压,平衡左移,NO2的物质的量增大,N2O4的物质的量减小,故
| c(NO 2) |
| c(N 2O 4) |
D、充入N2,保持体积不变,各物质的浓度不变,所以平衡不移动,故
| c(NO 2) |
| c(N 2O 4) |
故选C.
点评:本题考查化学平衡的移动,难度中等,①②是学生的易错点、难点,对于一种物质的分解反应,改变反应物的浓度等效为压强变化.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
实验室欲用氯化钠固体配制500mL、0.10mol?L-1的NaCl溶液,下列叙述正确的是( )
| A、实验用到的仪器有:托盘天平、烧杯、1000mL容量瓶、玻璃棒 |
| B、将称量好的固体放入500mL容量瓶中溶解 |
| C、定容时若俯视刻度,则所得溶液浓度偏高 |
| D、定容后翻转摇匀,发现液面下降,又加入蒸馏水到刻度线 |
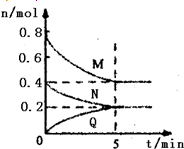 在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )A、该温度下此反应的平衡常数的值K=
| ||
| B、平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50% | ||
| C、若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% | ||
| D、在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) |
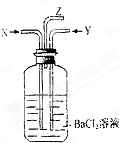 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )| A、洗气瓶中产生的沉淀是BaCO3 |
| B、在Z导管出来的气体中无CO2 |
| C、洗气瓶中产生的沉淀是BaSO3 |
| D、在Z导管口有红棕色气体出现 |
已知如下氧化还原反应2BrO3-+Cl2=Br2+2ClO3- 5Cl2+I2+6H2O=2HIO3+10HCl ClO3-+5Cl-+6H+=3Cl2+3H2O
则下列各微粒氧化能力强弱顺序正确的是( )
则下列各微粒氧化能力强弱顺序正确的是( )
| A、ClO3->BrO3->IO3->Cl2 |
| B、BrO3->Cl2>ClO3->IO3- |
| C、BrO3->ClO3->Cl2>IO3- |
| D、Cl2>BrO3->ClO3->IO3- |
将15%的NaOH溶液蒸发掉100g水后得到125ml质量分数为30%的NaOH溶液,则此时溶液的物质的量浓度为( )
| A、6 mol?L-1 |
| B、6.25 mol?L-1 |
| C、6.75 mol?L-1 |
| D、7 mol?L-1 |
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示.
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示. (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: