题目内容
9.下列设计的实验方案能达到实验目的是( )| A. | 制取无水MgCl2,将MgCl2溶液直接蒸干 | |
| B. | 除去CuCl2溶液中含有的少量FeCl2,向溶液中加入过量CuO,待充分反应后过滤 | |
| C. | 的检验:取少量试样于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,则试样中含有 | |
| D. | 探究反应的限度:将1mL0.1mol•L-1的KI溶液与5mL0.1mol•L-1的FeCl2溶液混合,待充分反应后,滴加KSCN溶液,观察实验现象 |
分析 A.氯化镁易水解;
B.氧化铜能与氢离子反应;
C.白色沉淀可能为AgCl;
D.KI溶液与FeCl2溶液不反应.
解答 解:A.氯化镁易水解,蒸干得到氢氧化镁,故A错误;
B.氧化铜能与氢离子反应,促进FeCl2水解,可除杂,故B正确;
C.向溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀可能为AgCl或硫酸钡,则溶液中可能含银离子或含有SO42-,但二者不能同时存在,故C错误;
D.KI溶液与FeCl2溶液不反应,无法完成实验,故D错误.
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、盐类的水解、离子的检验以及实验探究等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 23gNa与足量H2O反应完全后失去2NA个电子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含2NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9NA个电子 |
17.草酸二甲酯的水解产物草酸(H2C2O4)为二元弱酸.已知:
(1)草酸氢钾溶液中c(H+)>(填“>”“<”或“=”)c(OH-).
(2)向0.1mol•L-1的草酸氢钾溶液中滴加NaOH溶液至溶液呈中性,此时溶液中各粒子的浓度关系正确的是ad(填字母).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.cNa+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>cNa+)
(3)在浓度为1mol•L-1的HF与0.01mol•L-1的KHC2O4-混合溶液中逐滴加入1mol•L-1的CaCl2溶液,最初得到的沉淀为CaF2(填化学式).
| 难溶物 | CaF2 | CaC2O4 |
| Ksp | 3.5×10-11 | 2.3×10-9 |
| 酸 | HF | H2C2O4 |
| 电离常数 | Ka=7.2×10-4 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
(2)向0.1mol•L-1的草酸氢钾溶液中滴加NaOH溶液至溶液呈中性,此时溶液中各粒子的浓度关系正确的是ad(填字母).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.cNa+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>cNa+)
(3)在浓度为1mol•L-1的HF与0.01mol•L-1的KHC2O4-混合溶液中逐滴加入1mol•L-1的CaCl2溶液,最初得到的沉淀为CaF2(填化学式).
14.下列各组物质中,互为同分异构体的是( )
| A. | 石墨和富勒烯 | B. | H2O和H2O2 | C. | 1H 和 2H | D. | 乙醇和二甲醚 |
1.用铝灰(含有Al2O3、FeO、Fe203和少最SiO2)来的制备碱式硫酸铝[Al2(OH)4SO4],其工艺流程如下:
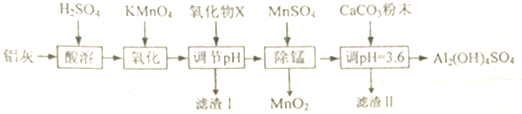
已知:生成氢氧化物沉淀的pH
(1)X为氧化铝,滤渣I的主要成分是二氧化硅和氢氧化铁,MnS04在“除锰”中的作用是还原剂
(2)设计一个简单的实验,证明上述流程中铁元素已被沉淀完全取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全
(3)写出第一次调节pH的范围[2.8,3.4),第二次调节pH时,若溶液的pH偏高,将会导致溶液中铝元素的含量降低
(4)加入CaC03制备碱式硫酸铝的化学方程式为Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.

已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(2)设计一个简单的实验,证明上述流程中铁元素已被沉淀完全取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全
(3)写出第一次调节pH的范围[2.8,3.4),第二次调节pH时,若溶液的pH偏高,将会导致溶液中铝元素的含量降低
(4)加入CaC03制备碱式硫酸铝的化学方程式为Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.
18.在光照条件下,CH4能与Cl2发生取代反应.若1mol CH4与一定的量的Cl2完全反应,反应后有四种取代产物生成,且四种产物物质的量相等,则消耗的Cl2为( )
| A. | 4 mol | B. | 2.5 mol | C. | 2 mol | D. | 0.5 mol |
19.丙烯酸(CH2=CH-COOH)可发生的化学反应类型有( )
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
| A. | 只有①②③ | B. | 只有①②③④ | C. | 只有①③④ | D. | 全部 |
 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题: