题目内容
14.已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.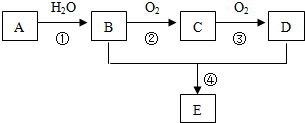
(1)反应①的类型加成反应
(2)物质E的结构简式CH3COOCH2CH3
(3)写出B生成C的反应方程式2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O.
分析 A 是一种分子量为28的气态烃,A是乙烯,其结构简式为CH2=CH2,
乙烯和水发生加成反应生成乙醇,B的结构简式为CH3CH2OH,
乙醇被氧化生成乙醛,C为CH3CHO,
乙醛被氧化生成乙酸,D为CH3COOH,
乙醇和乙酸发生酯化反应生成乙酸乙酯,E为CH3COOCH2CH3,根据有机物的结构和性质分析解答.
解答 解:A 是一种分子量为28的气态烃,也是一种重要的化工原料,A是乙烯,其结构简式为CH2=CH2,
乙烯和水发生加成反应生成乙醇,B的结构简式为CH3CH2OH,
乙醇被氧化生成乙醛,C为CH3CHO,
乙醛被氧化生成乙酸,D为CH3COOH,
乙醇和乙酸发生酯化反应生成乙酸乙酯,E为CH3COOCH2CH3,
(1)A为CH2=CH2,与水发生加成反应,故答案为:加成反应;
(2)E为CH3COOCH2CH3,故答案为:CH3COOCH2CH3;
(3)反应②是乙醇被氧化物乙醛,反应方程式为:2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O.
点评 本题以乙烯为载体考查的有机物推断,明确官能团及其性质是解有机推断题的关键,根据乙烯、乙醇、乙醛、乙酸、乙酸乙酯之间的转化关系来分析解答即可,难度不大.

练习册系列答案
相关题目
5.NA表示阿伏伽德罗常数的数值,下列判断正确的是( )
| A. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA | |
| C. | 46g乙醇中含有C-H键的数目为6NA | |
| D. | 常温下,2.7g金属铝与足量浓度为18mol/L的浓硫酸反应时转移的电子数为0.3NA |
19.丙烯酸(CH2=CH-COOH)可发生的化学反应类型有( )
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
| A. | 只有①②③ | B. | 只有①②③④ | C. | 只有①③④ | D. | 全部 |
6.W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )
| A. | 阴离子的还原性:Y>X | |
| B. | Y和Z的简单阴离子都会破坏水的电离平衡 | |
| C. | 最高价氧化物的水化物的酸性:Z>Y | |
| D. | 氢化物的热稳定性:W>X |
3.下列过程不涉及化学变化的是( )
| A. | 高炉炼铁 | B. | 海水蒸馏 | C. | 石油裂解 | D. | 煤的干馏 |
 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题: