题目内容
13.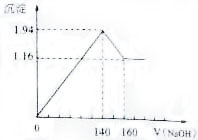 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)合金中Mg,Al的质量;
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)合金中Mg,Al的质量;(2)所用HCl的物质的量浓度.
分析 (1)由图可知,从加入氢氧化钠溶液就开始产生沉淀,加入氢氧化钠溶液为140mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=0.14L×0.5mol/L=0.07mol;从加入氢氧化钠溶液140mL~160mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.16L-0.14L)×0.5mol/L=0.01mol,代入上式计算n[Mg(OH)2],由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg、Al的质量;
(2)加入氢氧化钠溶液为140mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)由图可知,从加入氢氧化钠溶液就开始产生沉淀,加入氢氧化钠溶液为140mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=0.14L×0.5mol/L=0.07mol;从加入氢氧化钠溶液140mL~160mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.16L-0.14L)×0.5mol/L=0.01mol,则:3×0.01mol+2n[Mg(OH)2]=0.07mol,解得:n[Mg(OH)2]=0.02mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.02mol,所以Mg的质量为0.02mol×24g/mol=0.48g,
n(Al)=n[Al(OH)3]=0.01mol,Al的质量为:27g/mol×0.01mol=0.27g,
答:合金中Mg的质量为4.8g,Al的质量为0.27g.
(2)加入氢氧化钠溶液为140mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.14L×0.5mol/L=0.07mol,根据氯元素守恒n(HCl)=0.07mol,
所以盐酸的物质的量浓度为:$\frac{0.07mol}{0.1L}$=0.7mol/L,
答:盐酸的物质的量浓度为0.7mol/L.
点评 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算,试题培养了学生的化学计算能力.

| A. | 等于p% | B. | 大于p% | C. | 小于p | D. | 无法判断 |
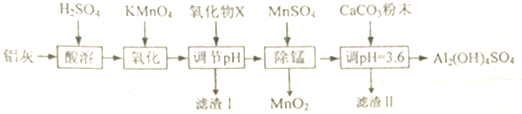
已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(2)设计一个简单的实验,证明上述流程中铁元素已被沉淀完全取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全
(3)写出第一次调节pH的范围[2.8,3.4),第二次调节pH时,若溶液的pH偏高,将会导致溶液中铝元素的含量降低
(4)加入CaC03制备碱式硫酸铝的化学方程式为Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.
| A. | ⅡA族 | B. | ⅣA族 | C. | Ⅵ族 | D. | ⅥA族 |
| A. | 4 mol | B. | 2.5 mol | C. | 2 mol | D. | 0.5 mol |
| A. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA | |
| C. | 46g乙醇中含有C-H键的数目为6NA | |
| D. | 常温下,2.7g金属铝与足量浓度为18mol/L的浓硫酸反应时转移的电子数为0.3NA |
| A. | 高炉炼铁 | B. | 海水蒸馏 | C. | 石油裂解 | D. | 煤的干馏 |
 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配置情况回答下列问题: