题目内容
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一.对下列反应的推断或解释正确的是( )
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 向淀粉KI溶液中不断通入C12 | 溶液变蓝后褪色 | C12先表现氧化性后表现漂白性 |
| C | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液 | 溶液不显红色 | 黑色固体没有Fe3O4 |
| D | 将SO2通入BaCl2溶液中 | 没有白色沉淀生成 | BaSO3可溶于酸 |
| A、A | B、B | C、C | D、D |
考点:物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题
分析:A.白色沉淀可能为AgCl;
B.氯气与KI反应生成碘,溶液变蓝,氯气作氧化剂;后褪色,与氯气强氧化性有关;
C.CO还原Fe2O3得到的黑色固体,为Fe,Fe与盐酸反应生成氯化亚铁;
D.SO2与BaCl2不反应.
B.氯气与KI反应生成碘,溶液变蓝,氯气作氧化剂;后褪色,与氯气强氧化性有关;
C.CO还原Fe2O3得到的黑色固体,为Fe,Fe与盐酸反应生成氯化亚铁;
D.SO2与BaCl2不反应.
解答:
解:A.白色沉淀可能为AgCl,某溶液中加入硝酸酸化的氯化钡溶液,溶液中可能含银离子或硫酸根离子,但二者不同时存在,故A错误;
B.氯气与KI反应生成碘,溶液变蓝,氯气作氧化剂;后褪色,是因次氯酸与碘单质反应生成碘酸,氯气不表现漂白性,故B错误;
C.CO还原Fe2O3得到的黑色固体,为Fe,Fe与盐酸反应生成氯化亚铁,所以再加入KSCN不能变红,则黑色固体没有Fe3O4,故C正确;
D.SO2与BaCl2不反应,不会生成BaSO3,故D错误;
故选C.
B.氯气与KI反应生成碘,溶液变蓝,氯气作氧化剂;后褪色,是因次氯酸与碘单质反应生成碘酸,氯气不表现漂白性,故B错误;
C.CO还原Fe2O3得到的黑色固体,为Fe,Fe与盐酸反应生成氯化亚铁,所以再加入KSCN不能变红,则黑色固体没有Fe3O4,故C正确;
D.SO2与BaCl2不反应,不会生成BaSO3,故D错误;
故选C.
点评:本题考查化学实验方案的评价,把握物质的性质、发生的反应及离子的检验为解答的关键,侧重离子检验及氧化还原反应的考查,注意实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,下列说法不正确的是( )
| A、Cl2既是氧化剂又是还原剂 |
| B、被氧化的氯原子数是被还原的氯原子数的5倍 |
| C、氧化剂和还原剂的质量比是5:1 |
| D、NaCl是还原产物,NaClO3是氧化产物 |
20℃时,H2S的饱和溶液1L,浓度约为1.0mol/L,其电离方程式为:第一步:H2S═H++HS-,第二步:HS-═H++S2-若使该溶液中c(H+)减小的同时c(S2-)也减小,可采用的措施是( )
| A、加入适量的NaOH |
| B、加入适量的水 |
| C、通入适量的SO2 |
| D、加入适量CuSO4固体 |
在指定的四种溶液中,因发生氧化还原不能大量共存的为( )
| A、含有NaI的无色透明溶液:K+、Ba2+、OH-、MnO4- |
| B、1.2mol/L CaCl2溶液:NH4+、SO42-、Na+、NO3- |
| C、能使紫色石蕊试液变蓝色的溶液:Ba2+、NO3-、NH4+、SO32- |
| D、所含溶质为KHSO4的溶液:Fe2+、Mg2+、NO3-、Cl- |
下列说法正确的是( )
| A、自发反应在任何条件下都能实现 |
| B、自发反应在恰当条件下才能实现 |
| C、凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| D、自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
下列溶液中微粒浓度关系一定正确的是( )
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)═c(H+) |
| C、0.1 mol?L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| D、0.1 mol?L-1的硫化钠溶液中:c(OH-)=c(H+)>c(HS-)>c(H2S) |
根据下列三个反应方程式,判断下列关系正确的是( )
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl3+2HI=2FeCl2+2HCl+I2
③2FeCl2+Cl2=2FeCl3.
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl3+2HI=2FeCl2+2HCl+I2
③2FeCl2+Cl2=2FeCl3.
| A、氧化性:FeCl3>Cl2>H2SO4>I2 |
| B、还原性:SO2>HI>FeCl2>HCl |
| C、2Fe+3I2=2FeI3 |
| D、6FeI2+3Cl2=2FeCl3+4FeI3 |
下列四个反应可用H++OH-=H2O表示的是( )
| A、氨水与盐酸反应 |
| B、向醋酸溶液中加入适量NaOH溶液 |
| C、稀硫酸与Ba(OH)2溶液反应 |
| D、NaOH溶液与稀硫酸反应 |
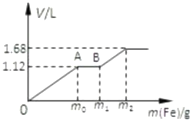 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.