题目内容
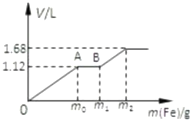 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.(1)写出O-A段反应的离子方程式
(2)原混合液中HNO3的物质的量浓度为
(3)参加反应的铁粉总质量为
考点:化学方程式的有关计算
专题:计算题
分析:氧化性:NO3->Fe3+>H+,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生:Fe+2Fe3+═3Fe2+,B以后发生:Fe+2H+=Fe2++H2↑,反应中NO3-完全被还原生成NO,根据氮元素守恒计算n(HNO3),进而计算c(HNO3),计算NO、H2的物质的量,根据电子转移守恒计算n(Fe),再根据m=nM计算参加反应Fe的质量.
解答:
解:氧化性:NO3->Fe3+>H+,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生:Fe+2Fe3+═3Fe2+,B以后发生:Fe+2H+=Fe2++H2↑,
(1)由上述分析可知,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,
故答案为:Fe+NO3-+4H+=Fe3++NO↑+2H2O;
(2)反应中NO3-完全被还原生成NO,根据氮元素守恒,n(HNO3)=n(NO)=
=0.05mol,所以c(HNO3)=
=1mol/L,
故答案为:1mol/L;
(3)n(NO)=0.05mol,H2的物质的量=
=0.025mol,根据电子转移守恒,n(Fe)=
=0.1mol,参加反应Fe的质量=0.1mol×56g/mol=5.6g,
故答案为:5.6g.
(1)由上述分析可知,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,
故答案为:Fe+NO3-+4H+=Fe3++NO↑+2H2O;
(2)反应中NO3-完全被还原生成NO,根据氮元素守恒,n(HNO3)=n(NO)=
| 1.12L |
| 22.4L/mol |
| 0.05mol |
| 0.05L |
故答案为:1mol/L;
(3)n(NO)=0.05mol,H2的物质的量=
| 1.68L-1.12L |
| 22.4L/mol |
| 0.05mol×3+0.025mol×2 |
| 2 |
故答案为:5.6g.
点评:本题考查混合物的计算,根据离子的氧化性强弱判断各阶段发生的反应是关键,难度中等,注意利用守恒法解答.

练习册系列答案
相关题目
分析下列各物质的物理性质,可判断其固态不属于分子晶体的是( )
| A、碳化铝,黄色晶体,熔点2200℃.熔融态不导电 |
| B、溴化铝,无色晶体,熔点98℃,熔融态不导电 |
| C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙铜中 |
| D、干冰,无色晶体,熔融时不导电 |
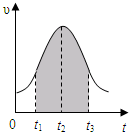 实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O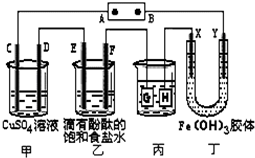 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
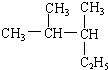
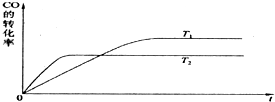 实际上电离平衡、盐的水解平衡等,它们都可看作是化学平衡的一种.请根据所学化学知识回答下列问题:
实际上电离平衡、盐的水解平衡等,它们都可看作是化学平衡的一种.请根据所学化学知识回答下列问题: