题目内容
已知反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,下列说法不正确的是( )
| A、Cl2既是氧化剂又是还原剂 |
| B、被氧化的氯原子数是被还原的氯原子数的5倍 |
| C、氧化剂和还原剂的质量比是5:1 |
| D、NaCl是还原产物,NaClO3是氧化产物 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,Cl元素的化合价由0升高为+5价,Cl元素的化合价由0降低为-1价,以此来解答.
解答:
解:A.只有Cl元素的化合价变化,既失去电子也得到电子,则Cl2既是氧化剂又是还原剂,故A正确;
B.由反应可知,1个Cl被氧化与5个Cl被还原时电子守恒,则被还原的氯原子数是被氧化的氯原子数的5倍,故B错误;
C.1个Cl被氧化与5个Cl被还原时电子守恒,结合Cl原子守恒可知氧化剂和还原剂的质量比是5:1,故C正确;
D.Cl元素化合价降低被还原,则NaCl为还原产物,Cl元素化合价升高被氧化,则氧化产物为NaClO3,故D正确;
故选B.
B.由反应可知,1个Cl被氧化与5个Cl被还原时电子守恒,则被还原的氯原子数是被氧化的氯原子数的5倍,故B错误;
C.1个Cl被氧化与5个Cl被还原时电子守恒,结合Cl原子守恒可知氧化剂和还原剂的质量比是5:1,故C正确;
D.Cl元素化合价降低被还原,则NaCl为还原产物,Cl元素化合价升高被氧化,则氧化产物为NaClO3,故D正确;
故选B.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及电子守恒的考查,题目难度不大.

练习册系列答案
相关题目
实现下列变化时,需克服相同类型作用力的是( )
| A、二氧化硅和干冰的熔化 |
| B、液溴和液汞的汽化 |
| C、金刚石和冰的熔化 |
| D、碘和干冰的熔化 |
向100mL a mol/L的AlCl3溶液中加入金属钾,完全反应后恰好只形成KCl和KAlO2的溶液,则加入钾的物质的量为( )
| A、0.1a mol |
| B、0.4a mol |
| C、0.3a mol |
| D、a mol |
下列说法不正确的是( )
| A、除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| B、“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 |
| C、“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| D、变色硅胶干燥剂含有CoCl2,干燥剂呈蓝色时,表示不具有吸水干燥功能 |
下列说法正确的是( )
| A、增加水的量或升高温度,可以加快镁跟水的反应速率 |
| B、增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率 |
| C、在反应2H++S2O32-=S↓+SO2+H2O中,增大压强,可以加快硫析出的速率 |
| D、煅烧硫铁矿时,把硫铁矿粉碎或通入纯O2可加快反应的速率 |
 某种固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.则下列判断错误的是( )
某种固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.则下列判断错误的是( )| A、a极为电池负极,电极反应为:O2+4e-═2O2- |
| B、有CH4放电的b极为电池的负极 |
| C、该电池的总反应为:CH4+2O2=2H2O+CO2 |
| D、b极对应的电极反应为:CH4-8e-+4O2-═CO2+2H2O |
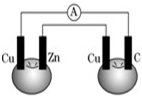 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )| A、锌片是负极 |
| B、两个铜片上都发生氧化反应 |
| C、石墨是阳极 |
| D、两个蕃茄都形成原电池 |
配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
| A、容量瓶中原有少量的蒸馏水 |
| B、定容时俯视刻度线和液面 |
| C、用适量蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液转移到容量瓶中 |
| D、移液时,不慎将液体流到瓶外 |