题目内容
下列说法正确的是( )
| A、自发反应在任何条件下都能实现 |
| B、自发反应在恰当条件下才能实现 |
| C、凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| D、自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:△H-T△S<0的反应能够自发进行,△H-T△S>0的反应不能够自发进行,反应能否自发进行,决定于焓变和熵变两个因素,缺一不可,据此分析.
解答:
解:△H-T△S<0的反应能够自发进行,△H-T△S>0的反应不能够自发进行,反应能否自发进行,决定于焓变和熵变两个因素,缺一不可,
A、放热的熵减小的反应在高温下不能自发进行,故A错误;
B、自发反应需要在一定条件下才能够实现,故B正确;
C、反应能否自发进行,决定于焓变和熵变两个因素,缺一不可,故C错误;
D、反应能否自发进行,决定于焓变和熵变两个因素,缺一不可,故D错误;
故选B.
A、放热的熵减小的反应在高温下不能自发进行,故A错误;
B、自发反应需要在一定条件下才能够实现,故B正确;
C、反应能否自发进行,决定于焓变和熵变两个因素,缺一不可,故C错误;
D、反应能否自发进行,决定于焓变和熵变两个因素,缺一不可,故D错误;
故选B.
点评:本题考查了反应自发进行的条件,注意根据:△H-T△S<0的反应能够自发进行,△H-T△S>0的反应不能够自发进行判断.

练习册系列答案
相关题目
下列说法正确的是( )
| A、增加水的量或升高温度,可以加快镁跟水的反应速率 |
| B、增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率 |
| C、在反应2H++S2O32-=S↓+SO2+H2O中,增大压强,可以加快硫析出的速率 |
| D、煅烧硫铁矿时,把硫铁矿粉碎或通入纯O2可加快反应的速率 |
下列离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | ||
B、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2AlO
| ||
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | ||
| D、FeCl2溶液中通入足量的Cl2:Fe2++Cl2═Fe3++2Cl- |
关于摩尔的叙述中,正确的是( )
| A、摩尔是表示物质质量的单位 |
| B、摩尔是表示物质数量的单位 |
| C、摩尔既表示物质微粒数量,又表示物质质量双重意义的单位 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
下列有机物的命名正确的是( )
| A、Br-CH2-CH2-Br二溴乙烷: |
B、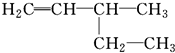 3-乙基-1-丁烯: 3-乙基-1-丁烯: |
C、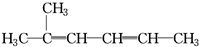 2-甲基-2,4-己二烯: 2-甲基-2,4-己二烯: |
D、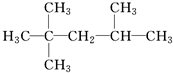 2,2,3-三甲基戊烷: 2,2,3-三甲基戊烷: |
下列说法中,不正确的是( )
| A、相对分子质量相同,组成元素的百分含量相同的不同有机物一定是同分异构体的关系 |
| B、碳原子数相同、结构不同的烷烃一定是互为同分异构体关系 |
| C、两有机物互为同系物,则它们也是互为同分异构体关系 |
| D、碳原子数≤10的烷烃,其一氯代物没有同分异构体的烷烃有4种 |
目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能.所用的原料仍然是Pb-PbO2-H2SO4,下列关于该铅酸蓄电池的说法正确的是( )
| A、充电时,电源的正极接蓄电池标“+”的一极,电池上标有“-”的一极发生氧化反应 |
| B、“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 |
| C、放电时,在铅酸蓄电池的负极发生还原反应 |
| D、若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12LCl2,电池内至少消耗H2SO40.10 mol |
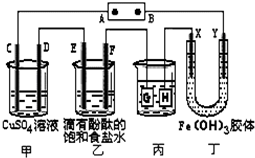 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.