题目内容
根据下列三个反应方程式,判断下列关系正确的是( )
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl3+2HI=2FeCl2+2HCl+I2
③2FeCl2+Cl2=2FeCl3.
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl3+2HI=2FeCl2+2HCl+I2
③2FeCl2+Cl2=2FeCl3.
| A、氧化性:FeCl3>Cl2>H2SO4>I2 |
| B、还原性:SO2>HI>FeCl2>HCl |
| C、2Fe+3I2=2FeI3 |
| D、6FeI2+3Cl2=2FeCl3+4FeI3 |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,据此分析解答.
解答:
解:AB:①2FeCl3+2KI=2FeCl2+2KCl+I2中,碘元素化合价升高,铁元素化合价降低,所以氯化铁作氧化剂,碘化钾作还原剂,还原产物是氯化亚铁,则还原性I->Fe2+,氧化性FeCl3>I2,
②2FeCl2+Cl2=2FeCl3中,氯元素化合价降低,铁元素化合价升高,所以氯气是氧化剂,氯化亚铁是还原剂,氯化铁是氧化产物和还原产物,所以还原性Fe2+>Cl-,则氧化性Cl2>FeCl3;
③I2+SO2+2H2O═H2SO4+2HI,I元素的化合价降低,S元素的化合价升高,所以碘单质是氧化剂,二氧化硫是还原剂,硫酸是氧化产物,氢碘酸是还原产物,所以
还原性SO2>I-,则氧化性I2>H2SO4,
则这四种离子的还原性大小顺序是:SO2>I->Fe2+>Cl-,氧化性大小顺序是:Cl2>FeCl3>I2>H2SO4,故A错误,B正确;
C、铁离子具有还原性,碘离子具有氧化性,二者之间不会发生反应得到碘化铁,而是碘化亚铁,故C错误;
D、碘化亚铁和氯气之间反应得到的是氯化铁、碘单质,氯气能将碘离子氧化,故D错误.
故选B.
②2FeCl2+Cl2=2FeCl3中,氯元素化合价降低,铁元素化合价升高,所以氯气是氧化剂,氯化亚铁是还原剂,氯化铁是氧化产物和还原产物,所以还原性Fe2+>Cl-,则氧化性Cl2>FeCl3;
③I2+SO2+2H2O═H2SO4+2HI,I元素的化合价降低,S元素的化合价升高,所以碘单质是氧化剂,二氧化硫是还原剂,硫酸是氧化产物,氢碘酸是还原产物,所以
还原性SO2>I-,则氧化性I2>H2SO4,
则这四种离子的还原性大小顺序是:SO2>I->Fe2+>Cl-,氧化性大小顺序是:Cl2>FeCl3>I2>H2SO4,故A错误,B正确;
C、铁离子具有还原性,碘离子具有氧化性,二者之间不会发生反应得到碘化铁,而是碘化亚铁,故C错误;
D、碘化亚铁和氯气之间反应得到的是氯化铁、碘单质,氯气能将碘离子氧化,故D错误.
故选B.
点评:本题考查了还原性、氧化性强弱的比较,明确还原剂、氧化剂和还原产物、氧化产物的判断是解本题关键,难度不大.

练习册系列答案
相关题目
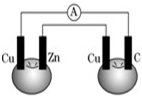 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )| A、锌片是负极 |
| B、两个铜片上都发生氧化反应 |
| C、石墨是阳极 |
| D、两个蕃茄都形成原电池 |
关于摩尔的叙述中,正确的是( )
| A、摩尔是表示物质质量的单位 |
| B、摩尔是表示物质数量的单位 |
| C、摩尔既表示物质微粒数量,又表示物质质量双重意义的单位 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
下列说法中,不正确的是( )
| A、相对分子质量相同,组成元素的百分含量相同的不同有机物一定是同分异构体的关系 |
| B、碳原子数相同、结构不同的烷烃一定是互为同分异构体关系 |
| C、两有机物互为同系物,则它们也是互为同分异构体关系 |
| D、碳原子数≤10的烷烃,其一氯代物没有同分异构体的烷烃有4种 |
下列物质中,能导电且为电解质的是( )
| A、熔融态的NaC1 | B、固体NaOH |
| C、铁 | D、稀硫酸 |
目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能.所用的原料仍然是Pb-PbO2-H2SO4,下列关于该铅酸蓄电池的说法正确的是( )
| A、充电时,电源的正极接蓄电池标“+”的一极,电池上标有“-”的一极发生氧化反应 |
| B、“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 |
| C、放电时,在铅酸蓄电池的负极发生还原反应 |
| D、若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12LCl2,电池内至少消耗H2SO40.10 mol |
分析下列各物质的物理性质,可判断其固态不属于分子晶体的是( )
| A、碳化铝,黄色晶体,熔点2200℃.熔融态不导电 |
| B、溴化铝,无色晶体,熔点98℃,熔融态不导电 |
| C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙铜中 |
| D、干冰,无色晶体,熔融时不导电 |