题目内容
20℃时,H2S的饱和溶液1L,浓度约为1.0mol/L,其电离方程式为:第一步:H2S═H++HS-,第二步:HS-═H++S2-若使该溶液中c(H+)减小的同时c(S2-)也减小,可采用的措施是( )
| A、加入适量的NaOH |
| B、加入适量的水 |
| C、通入适量的SO2 |
| D、加入适量CuSO4固体 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:H2S的电离方程式为:H2S?H++HS-、HS-=S2-+H+,若要使溶液的c(H+)减小和c(S2-)减小,应该使平衡向正反应方向移动,生成的硫离子和其它离子反应生成气体或沉淀,溶液中氢离子浓度增大,以此解答该题.
解答:
解:A.加入适量的NaOH溶液,氢氧根离子和氢离子反应生成水,促进了H2S的电离,溶液中c(S2-)增大,故A错误;
B.加入适量的水,溶液浓度减小,促进了H2S的电离,但溶液中c(H+)减小的同时c(S2-)也减小,故B正确;
C.通入适量的SO2,SO2+2H2S=3S↓+2H2O,抑制了H2S的电离,导致溶液中c(H+)减小的同时c(S2-)也减小,则符合条件,故C正确;
D.加入适量硫酸铜固体,H2S+CuSO4=CuS↓+H2SO4,氢硫酸是弱酸、硫酸是强酸,所以溶液中c(H+)增大,故D错误;
故选BC.
B.加入适量的水,溶液浓度减小,促进了H2S的电离,但溶液中c(H+)减小的同时c(S2-)也减小,故B正确;
C.通入适量的SO2,SO2+2H2S=3S↓+2H2O,抑制了H2S的电离,导致溶液中c(H+)减小的同时c(S2-)也减小,则符合条件,故C正确;
D.加入适量硫酸铜固体,H2S+CuSO4=CuS↓+H2SO4,氢硫酸是弱酸、硫酸是强酸,所以溶液中c(H+)增大,故D错误;
故选BC.
点评:本题考查了弱电解质的电离及其影响,题目难度中等,明确弱电解质的电离特点及物质之间的反应是解本题关键,根据溶液中离子浓度变化结合方程式分析解答.

练习册系列答案
相关题目
向100mL a mol/L的AlCl3溶液中加入金属钾,完全反应后恰好只形成KCl和KAlO2的溶液,则加入钾的物质的量为( )
| A、0.1a mol |
| B、0.4a mol |
| C、0.3a mol |
| D、a mol |
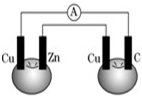 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )| A、锌片是负极 |
| B、两个铜片上都发生氧化反应 |
| C、石墨是阳极 |
| D、两个蕃茄都形成原电池 |
配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
| A、容量瓶中原有少量的蒸馏水 |
| B、定容时俯视刻度线和液面 |
| C、用适量蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液转移到容量瓶中 |
| D、移液时,不慎将液体流到瓶外 |
下列离子方程式书写正确的是( )
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | ||
B、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2AlO
| ||
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | ||
| D、FeCl2溶液中通入足量的Cl2:Fe2++Cl2═Fe3++2Cl- |
只用胶头滴管和试管,不用其它任何试剂,就可以区别的下列溶液是( )(浓度均为0.1mol/L)
①氯化钙和碳酸钠 ②碳酸钠和硫酸 ③氢氧化钙和碳酸氢钠 ④偏铝酸钠和盐酸.
①氯化钙和碳酸钠 ②碳酸钠和硫酸 ③氢氧化钙和碳酸氢钠 ④偏铝酸钠和盐酸.
| A、②③④ | B、②④ |
| C、①②③④ | D、①③ |
关于摩尔的叙述中,正确的是( )
| A、摩尔是表示物质质量的单位 |
| B、摩尔是表示物质数量的单位 |
| C、摩尔既表示物质微粒数量,又表示物质质量双重意义的单位 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
分析下列各物质的物理性质,可判断其固态不属于分子晶体的是( )
| A、碳化铝,黄色晶体,熔点2200℃.熔融态不导电 |
| B、溴化铝,无色晶体,熔点98℃,熔融态不导电 |
| C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙铜中 |
| D、干冰,无色晶体,熔融时不导电 |