题目内容
13.下列反应中氮元素既被氧化又被还原的是( )| A. | 2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{或△}$4NO2↑+O2↑+2H2O | D. | N2+O2 $\frac{\underline{\;放电\;}}{\;}$ 2NO |
分析 氮元素既被氧化又被还原,则反应为歧化反应,N元素的化合价既升高又降低,以此来解答.
解答 解:A.2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O反应中N元素的化合价升高仅被氧化,故A不选;
B.3NO2+H2O═2HNO3+NO反应中N元素的化合价既升高又降低,既被氧化又被还原,故B选;
C.4HNO3(浓)$\frac{\underline{\;光照\;}}{或△}$4NO2↑+O2↑+2H2O反应中N元素的化合价降低仅被还原,故C不选;
D.N2+O2 $\frac{\underline{\;放电\;}}{\;}$ 2NO反应中N元素的化合价升高仅被氧化,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
4. X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )
 X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )| A. | R的氧化物都含有离子键 | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | Y形成的化合物种类最多 |
4.现有A、B、C、D、E五种溶液分别是盐酸、醋酸、氢氧化钠溶液、氨水、碳酸钠溶液中的一种.常温下进行下列实验:
(1)A的溶质是Na2CO3,D的溶质是HC1,E的溶质是NaOH(均填化学式)
(2)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,相同条件下产生氢气的体积之比为1:3.
(3)将等体积、等物质的量浓度的B和C混合后所得溶液的PH为7,又己知醋酸的酸性强于碳酸,由此可推断碳酸氢铵水溶液呈碱(填“酸”、“碱”或“中”)性.
(4)将D溶液逐滴滴加到A溶液中,当滴入的D的物质的量与A相等时,溶液中所有阴离子的物质的量浓度由大到小的关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-).
| 序号 | 实验步骤和结论 |
| ① | 比较浓度均为0.1mol•L-1的A和E的pH的大小为:7<A<E |
| ② | 1L pH=9的A分别与x L 0.001mol•L-1 B,y L 0.001mol•L-1D充分反应后,当溶液均呈中性时x、y的大小关系为:y<x; |
| ③ | pH=a的C与pH=b的D,且a+b=14,等体积混合发生酸碱中和反应后,溶液呈碱性. |
(2)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,相同条件下产生氢气的体积之比为1:3.
(3)将等体积、等物质的量浓度的B和C混合后所得溶液的PH为7,又己知醋酸的酸性强于碳酸,由此可推断碳酸氢铵水溶液呈碱(填“酸”、“碱”或“中”)性.
(4)将D溶液逐滴滴加到A溶液中,当滴入的D的物质的量与A相等时,溶液中所有阴离子的物质的量浓度由大到小的关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-).
1.短周期元素X、Y、Z的原子序数依次递增?其原子的最外层电子数之和为13.X与Y、Z位于相邻周期?Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确的是 ( )
| A. | 简单离子半径:Z>Y>X | B. | 氢化物的稳定性:Z>X | ||
| C. | Z的最高价氧化物可用于漂白 | D. | X与Y形成的化合物为离子化合物 |
8.设NA为阿伏加德罗常败的数值,下列说法错误的是( )
| A. | 0.1 mol羟基 ( 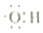 ) 中含有的电子数为0.7NA ) 中含有的电子数为0.7NA | |
| B. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA | |
| C. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COC-数目为NA | |
| D. | 14g乙烯与丙烯混合气体中的氢原子数为2NA |
18.下列实验“操作和现象”与“结论”对应关系正确的是( )
| A. | 向盛有某溶液的试管中加入盐酸酸化的硝酸钡,产生白色沉淀,则该溶液中一定含SO42- | |
| B. | 向盛有某溶液的试管中加入浓的强碱溶液,加热,用润湿的蓝色石蕊试纸置于管口,试纸变红,则该溶液中一定含有NH4+ | |
| C. | 向盛有某溶液的试管中加入硝酸银溶液,产生了白色沉淀,则该溶液中一定含有Cl- | |
| D. | 向盛有某溶液的试管中加入加入KSCN溶液显红色.则该溶液中一定含有Fe3+ |
5.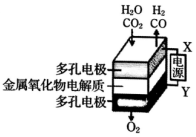 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | 阴极的反应式是:H2O+2e-=H2+O2-、CO2+2e-=CO+O2- | |
| B. | X是电源的负极 | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
2.饱和氯水长期放置后,下列微粒在溶液中不减少的是( )
| A. | HClO | B. | Cl- | C. | Cl2 | D. | ClO- |
3.在Na2CO3溶液中,下列等量关系成立的是( )
| A. | c(OH-)=c(HCO3-)+c(H2CO3) | B. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | ||
| C. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) |