题目内容
5.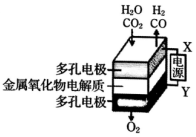 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | 阴极的反应式是:H2O+2e-=H2+O2-、CO2+2e-=CO+O2- | |
| B. | X是电源的负极 | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
分析 A.电解池阴极发生还原反应,根据反应物结合化合价的变化分析;
B.电解池阳极发生氧化反应,阴极发生还原反应,根据与X极相连的电极产生的气体判断;
C.根据图示以及电解的目的解答;
D.根据图示知:阴极产生H2、CO,阳极产生氧气,结合总的反应分析.
解答 解:A.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故A正确;
B.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故B正确;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,故C正确;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D错误;
故选D.
点评 本题考查电解知识,为高频考点,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阴极发生还原反应为解答关键.

练习册系列答案
相关题目
16.某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
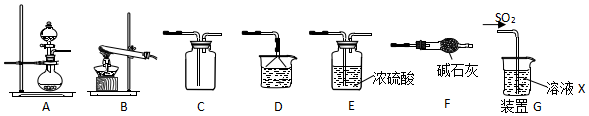
(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为AECED或AECD或AECF.
(2)D中盛装的试剂为NaOH溶液.
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的氧化性,可观察到的现象产生黄色沉淀.
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3-均能将H2SO3氧化为SO42-,不能说明谁先氧化H2SO3,他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应.请帮助他完成方案(包括操作现象和结论):取乙同学实验1后装置G中烧杯的上层清液于试管中,往试管中滴加铁氰化钾溶液,若溶液出现蓝色沉淀,则证明是Fe3+先氧化H2SO3,若溶液没有明显现象,则证明是pH=2的HNO3先氧化H2SO3.
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2?Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.

(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为AECED或AECD或AECF.
(2)D中盛装的试剂为NaOH溶液.
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的氧化性,可观察到的现象产生黄色沉淀.
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
| 实验 | 操作 | 现象 | 结论和解释 |
| 2 | 将SO2通入0.1mol/LFeCl3和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
| 3 | 将SO2通入0.01mol/LHNO3 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2?Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
13.下列反应中氮元素既被氧化又被还原的是( )
| A. | 2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{或△}$4NO2↑+O2↑+2H2O | D. | N2+O2 $\frac{\underline{\;放电\;}}{\;}$ 2NO |
20.下列溶液中,与100ml 0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L HCl溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L CaCl2溶液 |
10.把1molA和3molB投入2L密闭容器中发生反应A(g)+3B(g)?2C(g)+D(s),2min后,测得C的浓度为0.2mol/L,则下列说法正确的是( )
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
17.下列反应中,△S<0的是( )
| A. | H2(g)+Br2(g)?2HBr(g) | B. | 2N2O5(g)=4NO2(g)+O2(g) | ||
| C. | 2SO2(g)+O2?2SO3(g) | D. | CaCO3(s)=CaO(s)+CO2(g) |
14.用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)?2H2O(g)+2Cl2(g)△H>0 一定条件下在1L密闭容器中测得反应过程中n(Cl2)的实验数据如表.下列说法正确的是( )
| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 降低温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 平衡常数:K(200℃)<K(400℃) |