题目内容
4. X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法不正确的是( )| A. | R的氧化物都含有离子键 | B. | 最高价含氧酸的酸性:Z<Y | ||
| C. | M的氢化物常温常压下为气体 | D. | Y形成的化合物种类最多 |
分析 X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M最外层有6个电子,位于第VIA族;
R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素;
A.Na的氧化物由氧化钠和过氧化钠两种;
B.元素的非金属性越强,其最高价含氧酸的酸性越强;
C.M的氢化物的硫化氢;
D.C元素形成的有机物种类繁多.
解答 解:X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M最外层有6个电子,位于第VIA族;
R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素;
A.Na的氧化物由氧化钠和过氧化钠两种,但不论是氧化钠还是过氧化钠,结构中均含离子键,故A正确;
B.元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性Z>Y,所以其最高价含氧酸酸性Z>Y,故B错误;
C.M的氢化物的硫化氢,常温下为气体,故C正确;
D.Y为碳元素,而C元素形成的有机物种类繁多,远多于无机物的种类,故D正确;
故选B.
点评 本题考查原子结构和元素周期律,侧重考查学生推断及知识综合运用、灵活运用能力,明确离子半径比较方法、最高价含氧酸比较方法、物质结构是解本题关键,注意规律中的反常现象,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
14.下列物质的性质可以用“键能”来解释的是( )
| A. | SiO2熔点高 | B. | 氩气性质稳定 | C. | 碘易升华 | D. | NH3极易溶于水 |
15.下列化学用语所表示的微粒,对水的电离平衡没有影响的是( )
| A. |  | B. |  | C. | 1s22s22p63s1 | D. |  |
12.与HCl比,HI( )
| A. | 颜色更深 | B. | 沸点更低 | C. | 还原性更强 | D. | 稳定性更强 |
19.能用H++OH-=H2O表示的是( )
| A. | NaHSO4+NaOH=Na2SO4+H2O | B. | CH3COOH+NaOH→CH3COONa+H2O | ||
| C. | H2SO4+Ba(OH)2→BaSO4↓+2H2O | D. | NH3•H2O+HCl→NH4Cl+H2O |
9.下列过程中,涉及化学变化的是( )
| A. | 用黏土制作陶坯 | B. | 甘油加水作护肤剂 | ||
| C. | 用熟苹果催熟猕猴桃 | D. | 用四氯化碳擦去圆珠笔油渍 |
16.某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O
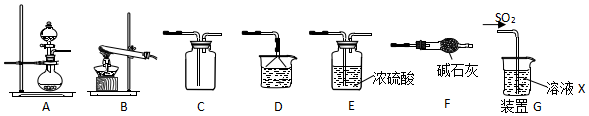
(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为AECED或AECD或AECF.
(2)D中盛装的试剂为NaOH溶液.
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的氧化性,可观察到的现象产生黄色沉淀.
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3-均能将H2SO3氧化为SO42-,不能说明谁先氧化H2SO3,他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应.请帮助他完成方案(包括操作现象和结论):取乙同学实验1后装置G中烧杯的上层清液于试管中,往试管中滴加铁氰化钾溶液,若溶液出现蓝色沉淀,则证明是Fe3+先氧化H2SO3,若溶液没有明显现象,则证明是pH=2的HNO3先氧化H2SO3.
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2?Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.

(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为AECED或AECD或AECF.
(2)D中盛装的试剂为NaOH溶液.
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的氧化性,可观察到的现象产生黄色沉淀.
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
| 实验 | 操作 | 现象 | 结论和解释 |
| 2 | 将SO2通入0.1mol/LFeCl3和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
| 3 | 将SO2通入0.01mol/LHNO3 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2?Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
13.实验室鉴别己烷、1-己烯和邻二甲苯,可选用的试剂是( )
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 氢氧化钠溶液和溴水 | D. | 溴水和酸性高锰酸钾溶液 |
13.下列反应中氮元素既被氧化又被还原的是( )
| A. | 2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{或△}$4NO2↑+O2↑+2H2O | D. | N2+O2 $\frac{\underline{\;放电\;}}{\;}$ 2NO |