题目内容
 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A、若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B、若x:y=1:2,则平衡时,M中的转化率:A>B |
| C、若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D、若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时N的体积为2.6L |
考点:化学平衡的计算
专题:
分析:M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、让M、N中平衡时A的体积分数相等,那么在M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,利用三段式表示平衡时各组分的物质的量,进而表示出A的体积分数,据此判断;
B、由于x:y=1:2,即y=2 x,设反应中消耗掉amolA,用a表示参加反应的B的物质的量,表示出转化率,据此比较;
C、题目中热化学方程式的意义为1molA完全反应,放热192 kJ,根据实际放出的热量计算参加反应的A的物质的量,进而表示出转化率进行判断;
D、根据平衡时C的物质的量,利用三段式计算出平衡时各组分的物质的量,根据压强一定时,物质的量之比等于体积比计算.
A、让M、N中平衡时A的体积分数相等,那么在M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,利用三段式表示平衡时各组分的物质的量,进而表示出A的体积分数,据此判断;
B、由于x:y=1:2,即y=2 x,设反应中消耗掉amolA,用a表示参加反应的B的物质的量,表示出转化率,据此比较;
C、题目中热化学方程式的意义为1molA完全反应,放热192 kJ,根据实际放出的热量计算参加反应的A的物质的量,进而表示出转化率进行判断;
D、根据平衡时C的物质的量,利用三段式计算出平衡时各组分的物质的量,根据压强一定时,物质的量之比等于体积比计算.
解答:
解:M容器保持恒容,N容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,
A、让M、N中平衡时A的体积分数相等,那么在M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,则:
A(g)+3B(g)?2C(g)
起始:x y
反应:z 3z 2z
平衡:x-z y-3z 2z
故平衡时A的体积分数为
,A的体积分数始终为定值,则x=y,故A正确;
B、x:y=1:2,即y=2 x,设反应中消耗掉amolA,则:
A(g)+3B(g)?2C(g)
初始(mol):x 2x 0
变化(mol):a 3a 2a
故A的转化率=
,B的转化率=
,则平衡时,M中的转化率:A<B,故B错误;
C、题目中热化学方程式的意义:若1molA完全反应,放热192 kJ,当M中放出热量172.8 kJ时,参加反应的A的物质的量为
×1mol=0.9mol,故A的转化率为
,故C错误;
D、若x=1.4,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,则:
A(g)+3B(g)?2C(g)
起始:1.4 1 0
反应:0.2 0.6 0.4
平衡:1.2 0.4 0.4
故A、B、C的平衡时的物质的量分别为1.2mol、0.4mol、0.4mol,则平衡时总物质的量为2mol,
根据压强一定时,物质的量之比等于体积比,设平衡时体积为VL,则
=
,所以V=
L,故D错误.
故选A.
A、让M、N中平衡时A的体积分数相等,那么在M或N中,反应前后不论限度多少,A的体积分数始终为定值,假定反应的A为zmol,则:
A(g)+3B(g)?2C(g)
起始:x y
反应:z 3z 2z
平衡:x-z y-3z 2z
故平衡时A的体积分数为
| x-z |
| x+y-2z |
B、x:y=1:2,即y=2 x,设反应中消耗掉amolA,则:
A(g)+3B(g)?2C(g)
初始(mol):x 2x 0
变化(mol):a 3a 2a
故A的转化率=
| a |
| x |
| 3a |
| 2x |
C、题目中热化学方程式的意义:若1molA完全反应,放热192 kJ,当M中放出热量172.8 kJ时,参加反应的A的物质的量为
| 172.8kJ |
| 192kJ |
| 0.9 |
| x |
D、若x=1.4,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,则:
A(g)+3B(g)?2C(g)
起始:1.4 1 0
反应:0.2 0.6 0.4
平衡:1.2 0.4 0.4
故A、B、C的平衡时的物质的量分别为1.2mol、0.4mol、0.4mol,则平衡时总物质的量为2mol,
根据压强一定时,物质的量之比等于体积比,设平衡时体积为VL,则
| 2.4mol |
| 2mol |
| 2L |
| VL |
| 5 |
| 3 |
故选A.
点评:本题考查化学平衡的计算、转化率的计算等,难度较大,D选项为易错点、难点,注意根据平衡常数判断平衡移动方向,A选项中注意数据的分析处理.

练习册系列答案
相关题目
 对硝基苯甲酸在医药、感光材料等工业中应用广泛.以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242℃,沸点约359℃,微溶于水,能升华.)的反应原理为:
对硝基苯甲酸在医药、感光材料等工业中应用广泛.以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242℃,沸点约359℃,微溶于水,能升华.)的反应原理为: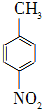 +Na2Cr2O7+4H2SO4→
+Na2Cr2O7+4H2SO4→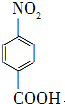 +Na2SO4+Cr2(SO4)3+5H2O
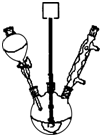
+Na2SO4+Cr2(SO4)3+5H2O 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去).