题目内容
将10g由Al、CuO、Fe2O3组成的混合物放入500ml某浓度的盐酸中,混合物完全溶解,当加入0.5mol的NaOH溶液时,得到的沉淀最多,则盐酸浓度为多少?
考点:有关混合物反应的计算
专题:
分析:Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸盐酸可能有剩余,向反应后溶液中加入NaOH溶液,得到的沉淀最大应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,根据氯离子守恒有n(HCl)=n(NaCl),根据钠离子守恒有n(NaCl)=n(NaOH),再根据c=
计算盐酸的浓度.
| n |
| V |
解答:
解:Al、CuO、Fe2O3组成的混合物共与盐酸反应生成氯化铝、氯化铜、氯化铁,盐酸盐酸可能有剩余,
向反应后溶液中加入NaOH溶液,得到的沉淀最多,应满足恰好反应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,
根据钠离子守恒可得:n(NaCl)=n(NaOH)=0.5mol,
根据氯离子守恒可得:n(HCl)=n(NaCl)=0.5mol,
故该元素的物质的量浓度=
=1mol/L,
答:该盐酸的物质的量浓度为1mol/L.
向反应后溶液中加入NaOH溶液,得到的沉淀最多,应满足恰好反应生成氢氧化铝、氢氧化铜、氢氧化铁,此时溶液中溶质为NaCl,
根据钠离子守恒可得:n(NaCl)=n(NaOH)=0.5mol,
根据氯离子守恒可得:n(HCl)=n(NaCl)=0.5mol,
故该元素的物质的量浓度=
| 0.5mol |
| 0.5L |
答:该盐酸的物质的量浓度为1mol/L.
点评:本题考查了有关混合物反应的计算,题目难度不大,注意掌握质量守恒定律在化学计算中的应用方法,本题中明确反应后的溶质组成为解答关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、0.5molO3与11.2LO2所含的分子数一定相等 |
| C、28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| D、500mL 1mol/LNa2SO4溶液中含Na+数目为NA |
下列离子方程式正确的是( )
| A、铁和硝酸银溶液反应:Fe+Ag+=Ag+Fe3+ |
| B、氢氧化镁与硫酸溶液反应:H++OH-=H2O |
| C、碳酸钙与醋酸溶液反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A、若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B、若x:y=1:2,则平衡时,M中的转化率:A>B |
| C、若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D、若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时N的体积为2.6L |
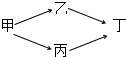 甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题:
甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题: