题目内容
6.甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)?CH3OH(g),在体积为1L的恒容密闭容器中,充人2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示.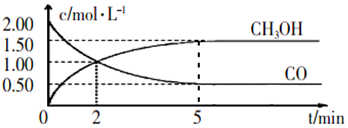
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=0.3mol/(L•min)
②下列说法正确的是B(填字母序号).
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充人氩气,反应速率减小 D.2min前v(正)>v(逆),2min后v(正)<v(逆)
分析 ①从反应开始到5min,图象可知CO难度变化为2.00mol/L-0.50mol/L=1.50mol/L,反应速率v=$\frac{△c}{△t}$;
②A.结合三行计算列式计算,转化率=$\frac{消耗量}{起始量}$×100%;
B.反应前后气体质量不变,气体物质的量变化,达到平衡状态平均相对分子质量不变;
C.达到平衡后,再充人氩气,总压增大分压不变,速率不变;
D.2min前后v(正)>v(逆).
解答 解:①从反应开始到5min,图象可知CO难度变化为2.00mol/L-0.50mol/L=1.50mol/L,从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=$\frac{1.50mol/L}{5min}$=0.3mol/(L•min),故答案为:0.3mol/(L•min);
②A.结合三行计算列式计算,
CO(g)+2H2(g)?CH3OH(g),
起始量 2 4 0
变化量 1.5 3 1.5
平衡量 0.5 1 1.5
达到平衡时,H2的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{3mol/L}{4mol/L}$×100%=75%,故A错误;
B.反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变,故B正确;
C.达到平衡后,再充人氩气,总压增大分压不变,速率不变,故C错误;
D.2min前后反应未达到平衡状态,反应正向进行,v(正)>v(逆),故D错误;
故答案为:B.
点评 本题考查了好像反应速率计算、化学平衡影响因素、注意平衡状态下恒温恒容容器中通入惰气总压增大,分压不变,平衡不变,反应速率不变,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | 乙酸分子比例模型: | |
| B. | 原子核内有18个中子的原子:${\;}_{17}^{35}$Cl | |
| C. | 1,2-二溴乙烷的结构简式:C2H4Br2 | |
| D. | 过氧化氢电子式: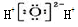 |
| A. | 已知 0.2 mol•L-1的NaHSO3溶液中pH<7,则溶液中一定有:c(H2SO3)<c(SO32-) | |
| B. | 0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+) | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 叠氮酸(HN3)与醋酸酸性相近,0.1 mol•L-1NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
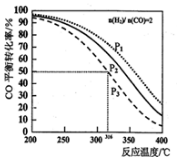
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
| A. | 1mol•L-1 NaClO4溶液中所含ClO4-数目为NA | |
| B. | 标准状况下,11.2L CCl4所含极性键的数目为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 在0.1molNaHSO4晶体中,阳离子与阴离子总数为0.3NA |
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 可溶于水的盐都是强电解质 | |
| C. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 | |
| D. | 熔融的电解质都能导电 |
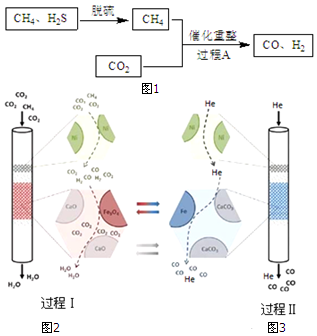
(1)以Fe(OH)3为脱硫剂,通过复分解反应吸收H2S,产物是H2O和Fe2S3.
(2)过程A主要涉及以下反应:
ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
①反应ⅰ的化学平衡常数K随温度的变化关系是K随温度升高而增大.
②分析反应ⅱ对反应ⅰ中CO2转化率可能的影响并说明理由:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率(写出一种即可).
(3)某科研团队利用Ni、CaO、Fe3O4三种催化剂在850℃下“超干重整”CH4和CO2:过程Ⅰ.通入CO2和
CH4,所得CO 被吸收,H2O被分离出体系,如图2所示.过程Ⅱ.H2O被分离后,向该装置中再通入He气,使催化剂再生并获得CO,如图3所示.
①CH4和CO2 重整为CO、H2O的热化学方程式是3CO2(g)+CH4(g)?4CO(g)+2H2O(g)△H2=+329kJ•mol-1.
②结合反应方程式简述Fe3O4的催化作用过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成.
③CaO对Fe3O4是否起到催化作用至关重要,实验研究结果如表:
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
| A. | 常温常压下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应小于0.1NA | |
| B. | 1molSO2与足量O2在一定条件下反应生成SO2,共转移2NA个电子 | |
| C. | 2.1gDTO中所含中子数为NA | |
| D. | 常温常压下,28gC2H4、CO的混合气体中含有碳原子的数目为1.5NA |