题目内容
15.将CH4、CO2催化重整为可用的化学品,对缓解能源危机、改善环境意义重大.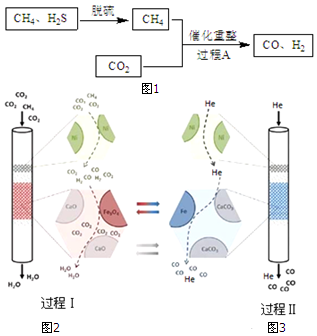
(1)以Fe(OH)3为脱硫剂,通过复分解反应吸收H2S,产物是H2O和Fe2S3.
(2)过程A主要涉及以下反应:
ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
①反应ⅰ的化学平衡常数K随温度的变化关系是K随温度升高而增大.
②分析反应ⅱ对反应ⅰ中CO2转化率可能的影响并说明理由:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率(写出一种即可).
(3)某科研团队利用Ni、CaO、Fe3O4三种催化剂在850℃下“超干重整”CH4和CO2:过程Ⅰ.通入CO2和
CH4,所得CO 被吸收,H2O被分离出体系,如图2所示.过程Ⅱ.H2O被分离后,向该装置中再通入He气,使催化剂再生并获得CO,如图3所示.
①CH4和CO2 重整为CO、H2O的热化学方程式是3CO2(g)+CH4(g)?4CO(g)+2H2O(g)△H2=+329kJ•mol-1.
②结合反应方程式简述Fe3O4的催化作用过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成.
③CaO对Fe3O4是否起到催化作用至关重要,实验研究结果如表:
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
分析 (1)复分解反应的实质是电解质在溶液中发生的离子间的互换反应;
(2)①升高温度,反应ⅰ的化学平衡正向移动,化学平衡常数K增大;
②从浓度、温度的改变分析化学平衡移动的方向,进而确定反应ⅰ中CO2转化率;
(3)①ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol,
根据盖斯定律,ⅰ-2×ⅱ可得3CO2(g)+CH4(g)?4CO(g)+2 H2O(g)△H;
②写出过程Ⅰ、Ⅱ涉及的化学方程式,通过方程式分析Fe3O4的作用;
③添加的CaO与CO2结合成CaCO3,降低了c(CO2),使过程Ⅰ中反应 4CO+Fe3O4?3Fe+4CO2平衡正向移动.
解答 解:(1)复分解反应的实质是电解质在溶液中发生的离子间的互换反应,各元素的化合价不变,因此Fe(OH)3与H2S发生复分解反应的产物应为H2O和Fe2S3,
故答案为:Fe2S3;
(2)①反应ⅰ为吸热反应,升高温度,平衡正向移动,化学平衡常数K增大,
故答案为:K随温度升高而增大;
②反应ⅱ消耗CO,降低了反应ⅰ中CO的浓度,使反应ⅰ的平衡正向移动,提高CO2的转化率;
反应ⅱ放热,升高温度,反应ⅰ的化学平衡正向移动,提高CO2的转化率;
反应ⅱ生成CO2,增大了反应ⅰ中CO2的浓度,使反应ⅰ的平衡正向移动,但降低CO2的转化率;
反应ⅱ生成H2,增大了反应ⅰ中H2的浓度,使反应ⅰ的平衡逆向移动,降低CO2的转化率,
故答案为:消耗CO、反应放热,都能使反应ⅰ的平衡正向移动,提高CO2的转化率;生成CO2使反应ⅰ的平衡正向移动,但降低CO2的转化率;生成H2使反应ⅰ的平衡逆向移动,降低CO2的转化率;
(3)①ⅰ.CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247kJ/mol,
ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol,
根据盖斯定律,ⅰ-2×ⅱ可得3CO2(g)+CH4(g)?4CO(g)+2 H2O(g)△H=+247kJ/mol+2×41kJ/mol=+329 kJ•mol-1,
故答案为:3CO2(g)+CH4(g)?4CO(g)+2 H2O(g)△H2=+329 kJ•mol-1;
②过程Ⅰ涉及的化学反应为4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4都是作氧化剂被还原,
过程Ⅱ中涉及的化学反应为3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成,
故答案为:过程Ⅰ4CO+Fe3O4?3Fe+4CO2,4H2+Fe3O4?3Fe+4H2O,Fe3O4被还原,过程Ⅱ3Fe+4CO2?4CO+Fe3O4,Fe3O4重新生成;
③CaO对Fe3O4是否起到催化作用至关重要,添加CaO时,还原产物有铁,不添加CaO,还原产物无铁,添加的CaO与CO2结合成CaCO3,降低了c(CO2),使过程Ⅰ中反应 4CO+Fe3O4?3Fe+4CO2平衡正向移动,所以有Fe生成,使Fe3O4催化作用更好,
故答案为:过程Ⅰ中存在平衡 4CO+Fe3O4?3Fe+4CO2,添加的CaO与CO2结合成CaCO3,降低了c(CO2),使平衡正向移动,所以有Fe生成,使Fe3O4催化作用更好.
点评 本题考查反应热的计算和化学平衡的影响因素,综合性较强,题目设置由易到难,掌握盖斯定律、勒夏特列原理是解题的关键,题目难度中等.

| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 25℃时,0.1mol•L-1Na2S溶液中含有Na+的数目为0.2NA | |
| D. | 将1mL5.68mol•L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体 |
| A. | C3H6Cl2有4种同分异构体 | |
| B. | 1,4-二甲基苯也称为间二甲苯 | |
| C. | 乙烯使溴水和高锰酸钾溶液褪色的原理相同 | |
| D. | 煤的干馏和石油的分馏均为物理变化 |
| A. | 创立侯氏制碱法 | B. | 发现青蒿素 | ||
| C. | 合成结晶牛胰岛素 | D. | 发明元素周期表 |
 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.