题目内容
14.甲醚是一种清洁燃料,以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是( )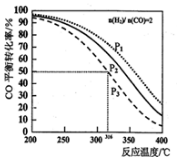
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
分析 A.根据图知,相同压强下,升高温度,CO的转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动;
B.相同温度下,增大压强,平衡向气体体积减小的方向移动;
C.$\frac{n({H}_{2})}{n(CO)}$=2,设通入的n(H2)=2xmol、n(CO)=xmol,在P3和316℃时,达到平衡状态时,CO的转化率为50%,
发生的反应2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)
开始(mol/L)x 2x 0 0
反应(mol/L)0.5x x 0.25x 0.25x
平衡(mol/L)0.5x x 0.25x 0.25x
根据方程式知,平衡时n(H2)>n(CH3OCH3),要使二者物质的量相等,平衡应该正向移动;
D.相同温度和压强下,增大一种气体反应物浓度,能提高另一种气体物质的转化率.
解答 解:A.根据图知,相同压强下,升高温度,CO的转化率降低,说明平衡逆向移动,升高温度平衡向吸热方向移动,所以正反应是放热反应,则上述反应△H<0,故A正确;
B.相同温度下,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动,所以压强越大CO的转化率越大,根据图中CO转化率大小顺序知,P1>P2>P3,故B错误;
C.$\frac{n({H}_{2})}{n(CO)}$=2,设通入的n(H2)=2xmol、n(CO)=xmol,在P3和316℃时,达到平衡状态时,CO的转化率为50%,
发生的反应2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)
开始(mol/L)x 2x 0 0
反应(mol/L)0.5x x 0.25x 0.25x
平衡(mol/L)0.5x x 0.25x 0.25x
根据方程式知,平衡时n(H2)>n(CH3OCH3),要使二者物质的量相等,平衡应该正向移动,则此时v(正)>v(逆),故C正确;
D.相同温度和压强下,增大一种气体反应物浓度,能提高另一种气体物质的转化率,所以增大氢气浓度时能提高CO转化率,则若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率大于50%,故D错误;
故选AC.
点评 本题考查化学平衡计算及图象分析,为高频考点,侧重考查学生分析判断及计算能力,明确温度、压强对化学平衡影响原理是解本题关键,易错选项是C,注意利用物质的量之间的关系确定反应方向,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 苯(硝基苯) | B. | 乙醇(乙酸) | C. | 乙酸乙酯(乙酸) | D. | 乙酸(苯) |
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 25℃时,0.1mol•L-1Na2S溶液中含有Na+的数目为0.2NA | |
| D. | 将1mL5.68mol•L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体 |
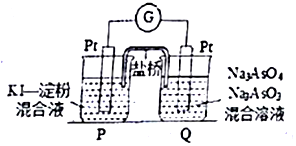 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)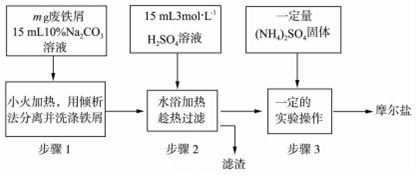

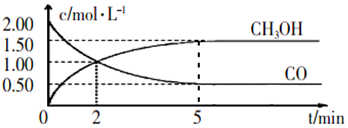
 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.