题目内容
16.下列化学用语表达正确的是( )| A. | 乙酸分子比例模型: | |
| B. | 原子核内有18个中子的原子:${\;}_{17}^{35}$Cl | |
| C. | 1,2-二溴乙烷的结构简式:C2H4Br2 | |
| D. | 过氧化氢电子式: |
分析 A.图为乙醛的比例模型;
B.氯原子的核电荷数为17,质量数=质子数+中子数;
C.根据2个溴原子分布在不同的碳原子上;
D.过氧化氢为共价化合物.
解答 解:A.乙酸分子比例模型: ,故A错误;
,故A错误;
B.Cl的质子数为17,中子数为18,质量数为35,可表示:${\;}_{17}^{35}$Cl,故B正确;
C.1,2-二溴乙烷的结构简式为:CH2BrCH2Br,故C错误;
D.过氧化氢为共价化合物,电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题主要考查了常见化学用语的表示方法,题目难度不大,涉及电子式、比例模型、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列物质(括号内为少量杂质),能用饱和Na2CO3溶液并借助分液漏斗把杂质除去的是( )
| A. | 苯(硝基苯) | B. | 乙醇(乙酸) | C. | 乙酸乙酯(乙酸) | D. | 乙酸(苯) |
11.下列说法符合事实的是( )
| A. | 常温下,加入铝粉能够产生氢气的溶液中水电离的c(H+)一定小于10-7mol•L-1 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含Cl-、CrO42-浓度相同的溶液中滴加稀AgNO3溶液时,先生成Ag2CrO4沉淀 | |
| C. | 温度一定时,强电解质溶液的导电能力一定比弱电解质溶液强 | |
| D. | 实验室用锌制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
1.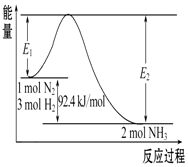 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.
合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
(1)在反应体系中加入催化剂,反应速率增大,E2的变化是减小(填“增大”、“减小”或“不变”)
(2)该反应的反应热△H=-92.4KJ/mol,已知E2=212.4 kJ/mol,则该反应正反应的活化能是120KJ/mol
(3)该反应化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$该反应的化学平衡常数K和温度t的关系如表所示:
则K1>K2(填>、<、=)
(4)该反应的△S<0,(填大于、小于或等于),理论上在低温条件下可以自发.
 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
(1)在反应体系中加入催化剂,反应速率增大,E2的变化是减小(填“增大”、“减小”或“不变”)
(2)该反应的反应热△H=-92.4KJ/mol,已知E2=212.4 kJ/mol,则该反应正反应的活化能是120KJ/mol
(3)该反应化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$该反应的化学平衡常数K和温度t的关系如表所示:
| t℃ | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(4)该反应的△S<0,(填大于、小于或等于),理论上在低温条件下可以自发.
8.化学学习小组进行如下实验.
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究温度对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为1.0;乙是实验需要测量的物理量,则表 格中“乙”应填写t 溶液褪色时间/s.
【测定 H2C2O4•xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000mol•L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是b(选填 a、b).
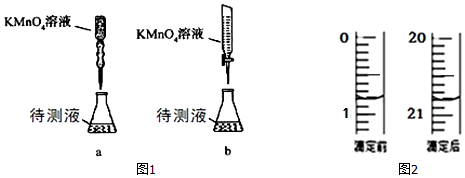
(4)由图2可知消耗 KMnO4溶液体积为20.00mL;
(5)滴定过程中眼睛应注视锥形瓶中颜色变色;
(6)通过上述数据,求得 x=2.以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果偏大(偏大、偏小或没有影响).
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
【测定 H2C2O4•xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000mol•L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是b(选填 a、b).

(4)由图2可知消耗 KMnO4溶液体积为20.00mL;
(5)滴定过程中眼睛应注视锥形瓶中颜色变色;
(6)通过上述数据,求得 x=2.以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果偏大(偏大、偏小或没有影响).




 .
.