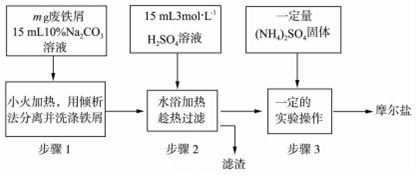
题目内容
1.已知NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 1mol•L-1 NaClO4溶液中所含ClO4-数目为NA | |
| B. | 标准状况下,11.2L CCl4所含极性键的数目为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 在0.1molNaHSO4晶体中,阳离子与阴离子总数为0.3NA |
分析 A.溶液体积未知;
B.气体摩尔体积使用对象为气体;
C.过氧化钠与水反应为歧化反应,生成1mol氧气转移2mol电子;
D.硫酸氢钠中含有阳离子为钠离子.
解答 解:A.溶液体积未知,无法计算溶液中微粒数,故A错误;
B.标况下,四氯化碳为液体,不能使用气体摩尔体积,故B错误;
C.过氧化钠与水反应为歧化反应,生成1mol氧气转移2mol电子,所以生成0.1mol氧气转移的电子数为0.2NA,故C正确;
D.在0.1molNaHSO4晶体中,含有0.1mol钠离子,0.1mol硫酸氢根离子,共含有阳离子与阴离子总数为0.2NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象,注意过氧化钠、硫酸氢钠的结构组成,题目难度中等.

练习册系列答案
相关题目
11.下列说法符合事实的是( )
| A. | 常温下,加入铝粉能够产生氢气的溶液中水电离的c(H+)一定小于10-7mol•L-1 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含Cl-、CrO42-浓度相同的溶液中滴加稀AgNO3溶液时,先生成Ag2CrO4沉淀 | |
| C. | 温度一定时,强电解质溶液的导电能力一定比弱电解质溶液强 | |
| D. | 实验室用锌制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
16.已知自然界氧的同位素有16O、17O、18O,与氢的其中两种同位素H、D组成水分子,从水分子的原子组成来看,此水一共有( )
| A. | 3种 | B. | 18种 | C. | 9种 | D. | 12种 |
13.某元素在化学反应中由化合态变成游离态,则下列说法正确的是( )
| A. | 该元素一定被氧化 | B. | 该元素一定被还原 | ||
| C. | 该元素可能被氧化也可能被还原 | D. | 生成的单质为还原产物 |
10.下列关于有机化合物说法正确的是( )
| A. | C3H6Cl2有4种同分异构体 | |
| B. | 1,4-二甲基苯也称为间二甲苯 | |
| C. | 乙烯使溴水和高锰酸钾溶液褪色的原理相同 | |
| D. | 煤的干馏和石油的分馏均为物理变化 |
11.常温下,下列有关说法正确的是( )
| A. | 0.1 mol•L-1的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,c(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的①NaHCO3溶液②CH3COONa溶液中的c(Na+):①>② |