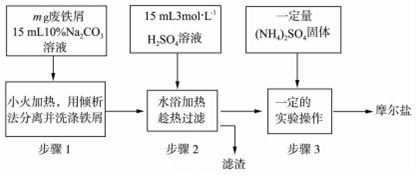
题目内容
17.常温下,下列说法不正确的是( )| A. | 已知 0.2 mol•L-1的NaHSO3溶液中pH<7,则溶液中一定有:c(H2SO3)<c(SO32-) | |
| B. | 0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+) | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 叠氮酸(HN3)与醋酸酸性相近,0.1 mol•L-1NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
分析 A.已知 0.2 mol•L-1的NaHSO3溶液中pH<7,溶液显酸性,HSO3-电离大于其水解程度;
B.0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液生成Na2C2O4溶液,溶液中电荷守恒和物料守恒计算分析判断;
C.溶液中存在电荷守恒;
D.NaN3水溶液呈碱性,N3-水解.
解答 解:A.已知 0.2 mol•L-1的NaHSO3溶液中pH<7,溶液显酸性,HSO3-电离大于其水解程度,c(H2SO3)<c(SO32-),故A正确;
B.0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液生成Na2C2O4溶液,根据物料守恒得c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-),根据电荷守恒得c(H+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),所以得c(H+)+2c(H2C2O4)+c(HC2O4-)=c(OH-),故B错误;
C.向氨水中逐滴滴入盐酸至溶液的pH=7,c(H+)=c(OH-),溶液中电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),则混合液中c(NH4+)=c(Cl-),故C正确;
D.叠氮酸(HN3)与醋酸酸性相似,醋酸钠溶液呈碱性,则NaN3水溶液呈碱性,存在c(Na+)>c(N3-)>c(OH-)>c(H+),故D正确;
故选B.
点评 本题考查离子浓度的大小比较、电荷守恒、物料守恒,题目难度中等,注意把握题给信息,此为解答该题的关键,注意亚硫酸钠溶液中亚硫酸根离子水解程度小于亚硫酸根离子电离.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.化学学习小组进行如下实验.
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究温度对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为1.0;乙是实验需要测量的物理量,则表 格中“乙”应填写t 溶液褪色时间/s.
【测定 H2C2O4•xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000mol•L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是b(选填 a、b).
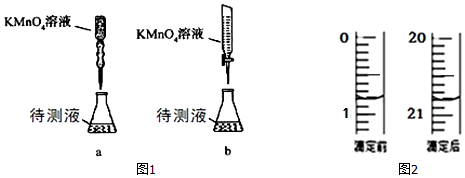
(4)由图2可知消耗 KMnO4溶液体积为20.00mL;
(5)滴定过程中眼睛应注视锥形瓶中颜色变色;
(6)通过上述数据,求得 x=2.以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果偏大(偏大、偏小或没有影响).
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
| 物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 25 | |
| ③ | 1.0 | a | 4.0 | 25 |
【测定 H2C2O4•xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000mol•L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是b(选填 a、b).

(4)由图2可知消耗 KMnO4溶液体积为20.00mL;
(5)滴定过程中眼睛应注视锥形瓶中颜色变色;
(6)通过上述数据,求得 x=2.以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果偏大(偏大、偏小或没有影响).
 .
.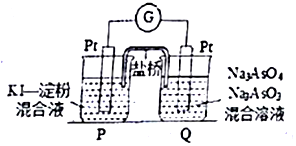 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)