题目内容
11.下列说法正确的是 ( )| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 可溶于水的盐都是强电解质 | |
| C. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 | |
| D. | 熔融的电解质都能导电 |
分析 A.电解质的强弱与溶解性无关;
B.在水中完全电离的电解质属于强电解质;
C.电解质在溶液中会电离出自由移动的离子;
D.HCl等共价化合物在熔融时不能电离.
解答 解:A.电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故A错误;
B.绝大多数的盐属于强电解质,少部分盐属于弱电解质,如醋酸铅是易溶于水的弱电解质,故B错误;
C.电解质在溶液中会电离出自由移动的离子,即电解质溶液导电的原因是溶液中有自由移动的阴阳离子,故C正确;
D.HCl等共价化合物在熔融时不能电离,没有自由移动的离子,所以不能导电,故D错误.
故选C.
点评 本题考查了电解质、非电解质的概念、强弱电解质的概念以及判断,题目难度不大,涉及溶液导电的原因、强弱电解质的辨析等,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
1.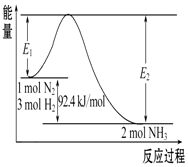 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.
合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
(1)在反应体系中加入催化剂,反应速率增大,E2的变化是减小(填“增大”、“减小”或“不变”)
(2)该反应的反应热△H=-92.4KJ/mol,已知E2=212.4 kJ/mol,则该反应正反应的活化能是120KJ/mol
(3)该反应化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$该反应的化学平衡常数K和温度t的关系如表所示:
则K1>K2(填>、<、=)
(4)该反应的△S<0,(填大于、小于或等于),理论上在低温条件下可以自发.
 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
(1)在反应体系中加入催化剂,反应速率增大,E2的变化是减小(填“增大”、“减小”或“不变”)
(2)该反应的反应热△H=-92.4KJ/mol,已知E2=212.4 kJ/mol,则该反应正反应的活化能是120KJ/mol
(3)该反应化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$该反应的化学平衡常数K和温度t的关系如表所示:
| t℃ | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(4)该反应的△S<0,(填大于、小于或等于),理论上在低温条件下可以自发.
3.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 25℃时,0.1mol•L-1Na2S溶液中含有Na+的数目为0.2NA | |
| D. | 将1mL5.68mol•L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体 |
20.下列贡献与中国科学家无关的是( )
| A. | 创立侯氏制碱法 | B. | 发现青蒿素 | ||
| C. | 合成结晶牛胰岛素 | D. | 发明元素周期表 |
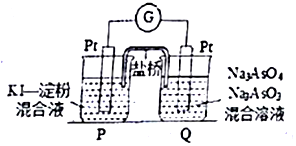 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
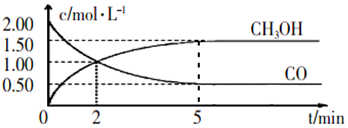
 .
.