题目内容
15.若阿伏加德罗常数记为NA,则12g 14C(原子核内有6个质子8个中子)含有14C原子数(已知一个14C的质量比一个12C的质量大)( )| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
分析 14C的相对原子质量为14,则摩尔质量为14g/mol,根据微粒个数N=$\frac{m}{M}{N}_{A}$来计算.
解答 解:14C的相对原子质量为14,则摩尔质量为14g/mol,故12g14C中含有的14C原子个数N=$\frac{m}{M}{N}_{A}$=$\frac{12g}{14g/mol}×{N}_{A}/mol$=$\frac{6}{7}{N}_{A}$个,故选B.
点评 本题考查了微粒个数的求算,应注意碳元素的不同种碳原子的摩尔质量在数值上等于各原子的质量数,难度不大.

练习册系列答案
相关题目
6.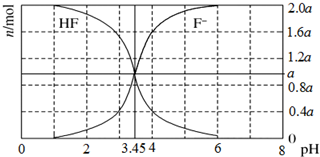 25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
 25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3.45时,溶液中:c(Na+)+c(H+)=c(HF)+c(OH-) | |
| B. | pH=3时,溶液中:c(Na+)>c(F-) | |
| C. | n(F-)=0.6a mol时,溶液中:c(Na+)>c(HF) | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol/L |
20.下列各反应中,生成物总能量比反应物总能量高的是( )
| A. | 电解饱和食盐水 | B. | 铁生锈 | C. | 木炭燃烧 | D. | 工业合成氨 |
7.现有常温下的四种溶液(如表):
下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| B. | 将③、④分别稀释到pH=5,由水电离出氢离子的浓度均减小100倍 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)>1 |