题目内容
13.我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出.该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法.I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成.
①该反应的离子方程式为2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O.
②该反应在25-50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为H2O2受热分解,产物Cu2+、Fe3+催化H2O2分解等.
Ⅱ.配位浸出
反应原理为:CuFeS2+NH3•H2O+O2+OH-→Cu(NH3)O42++Fe2O3+SO42-+H2O(未配平)
(2)为提高黄铜矿的浸出率,可采取的措施有提高氨水的浓度、提高氧压(至少写出两点).
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4Cl,构成NH3•H2O-NH4Cl缓冲溶液.某小组在实验室对该缓冲体系进行了研究:25℃时,向amol/L的氨水中缓慢加入等体积0.02mol/L的NH4Cl溶液,平衡时溶液呈中性.则NH3•H2O的电离常数Kb=$\frac{2×1{0}^{-9}}{a}$(用含a的代数式表示);滴加NH4Cl溶液的过程中水的电离平衡正向(填“正向”、“逆向”或“不”)移动.
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示.
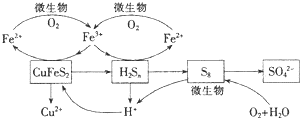
(4)在微生物的作用下,可以循环使用的物质有Fe2(SO4)3、H2SO4(填化学式),微生物参与的离子反应方程式为4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O(任写一个).
(5)假如黄铜矿中的铁元素最终 全部转化为Fe3+,当有2mol SO42-生成时,理论上消耗O2的物质的量为4.25mol.
分析 (1)①双氧水将黄铜矿(CuFeS2)氧化得到硫酸根和三价铁;
②H2O2受热分解,Cu2+、Fe3+是H2O2分解的催化剂;
(2)增大一种反应物的浓度,可提高另一种反应物的转化率;
(3)向amol.L-l的氨水中缓慢加入等体积0.02mol.L-l的NH4C1溶液,平衡时溶液呈中性,则c(NH4+)=c(Cl-)=0.01mol/L,根据Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$计算;
(4)由图知Fe2(SO4)3、H2SO4是中间产物;在微生物作用下,氧气把亚铁离子氧化为铁离子;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根,根据得失电子守恒计算.
解答 解:(1)①双氧水将黄铜矿氧化得到硫酸根和三价铁,离子方程式为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O,
故答案为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
②H2O2不稳定,H2O2受热易分解,产物Cu2+、Fe3+催化H2O2分解,
故答案为:H2O2受热分解,产物Cu2+、Fe3+催化H2O2分解等;
(2)增大一种反应物的浓度,可提高另一种反应物的转化率,可提高氨水的浓度、提高氧压,
故答案为:提高氨水的浓度、提高氧压;
(3)在25℃下,氨水微弱电离,浓度约为0.5a,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,则c(NH4+)=c(Cl-)=0.01mol/L,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{1{0}^{-7}×0.01}{0.5a}$=$\frac{2×1{0}^{-9}}{a}$;铵根能与氢氧根结合,促进水的电离,则水的电离平衡向正方向移动;
故答案为:$\frac{2×1{0}^{-9}}{a}$;正向;
(4)由图知Fe2(SO4)3、H2SO4是中间产物,可循环使用,离子反应方程式为4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O,
故答案为:Fe2(SO4)3、H2SO4;4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根,当有2mol SO42-生成时,失去电子工17mol,消耗O2的物质的量为$\frac{17}{4}$mol=4.25mol,
故答案为:4.25 mol.
点评 本题考查物质的分离提纯、电离常数的计算以及氧化还原反应的计算等知识,侧重考查基本理论及计算能力,题目难度中等,侧重于考查学生的分析能力和计算能力.

| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
| A. | 甲醛 | B. | 生石灰 | C. | 过氧化氢 | D. | 次氯酸钠 |
 对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )
对氨基苯酚(PAP)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示.下列说法正确的是( )| A. | 电解时Pt电极应与直流电源的负极相连 | |
| B. | 电解时Pt电极上有H2放出 | |
| C. | 阴极反应式为:C6H5NO2+4e-+4H+═HOC6H4NH2+H2O | |
| D. | 电解一段时间后,硫酸溶液的pH不变化 |
| A. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5NA | |
| B. | 0.1 mol CnH2n+2中含有的共用电子对数为0.3nNA | |
| C. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数2NA | |
| D. | 电解精炼铜时,阳极质量减少64g,则阴极得到的电子数为2NA |
| A. | 胶粒可以导电 | B. | 胶体是混合物 | ||
| C. | 胶体的分散剂为气体 | D. | 胶体粒子大小在1~100nm 之间 |
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铁棒插入浓硝酸中,无明显现象 | 铁与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 原溶液中可能含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |

